脳の秘密を解き明かす
2014年4月23日
利根川 進
理研脳科学総合研究センター長
脳は私たちの身体のなかで最も複雑な臓器である。数十年にわたる研究の成果により、個々の脳細胞がどのように機能し、また互いに作用してネットワークを形成するのか、そのネットワークがどのように思考や行動を生み出すのか、さらに、脳機能を修復したり向上させたりするために私たちはどうしたらよいのか、といった問いに対する答えが明らかになり始めている。このような脳研究における飛躍的な進歩は、近年の技術革新によって支えられてきた。今後さらに技術が進むことで、さまざまな神経性・神経変成疾患や精神疾患を発病した人々の治療を改善することが可能となり、また、脳がどのように私たちの意識や認知を生み出しているのかについての理解が深まるだろう。
ヒトの脳は数千億個もの神経細胞が約1千兆の結合をすることで成り立っており、その複雑さのレベルは多層的にわたり相互に作用をしている。脳には数万種類にわたる神経細胞(ニューロン)が存在するが、それぞれに特有の遺伝子が発現し、その形態や他の細胞との結合の仕方は固有である。
ニューロンには2種類の突起がある。一つまたは複数ある樹状突起は信号を受け、一本の軸索は受け取った信号を次の細胞へと伝達する。シナプスと呼ばれる結合部を介して、ニューロンは複雑な層状の重なり合う信号のネットワーク(神経回路)を形成している。神経科学における第一の目的は、神経回路の形成の仕組みとその機能を理解することである。そうすることで、ニューロンの細胞レベルの活動がどのように言語や記憶といった高次認知機能につながっているのか、また脳が影響をうける様々な状況において、どのようにしてこれらの機能が働かなくなるのかを明らかすることができる。
脳は、思考や感情、意識など、ヒトをヒトたらしめるものすべてを生み出している。しかし、直接ヒトの脳の研究に適用できる技術には限界がある。例えば機能的核磁器共鳴法(fMRI)はヒトの脳活動を可視化できるが、時空間的解像度は低い。また、動物に適用される多くの実験手法は、遺伝子工学を用いたり、侵襲性が高かったりするためにヒトには応用できない。
言語や感情、意識などの高次認知機能を生み出すような神経回路の活動を理解するには、したがって、大きな技術的革新が必要である。もしそのような技術革新がおこれば、まさに1970年代前半に遺伝子組換え技術が生物学に革命を起こしたのと同様に、脳研究に革命がもたらされるであろう。世界中のそして理研BSIの脳科学者たちは、近年大きく前進しており、脳科学という研究分野を発展めざましく、エキサイティングなものにしてきた。
脳は複雑で、その働きは多岐にわたっており、また物理的にアクセスしづらい。したがって、脳科学者たちは多種多様なアプローチを融合させ、研究を進めなければならない。BSIは、心理学、物理学、細胞生物学、遺伝学、数学、工学とロボット工学を含む専門家によるチームを集めることにより、これを成し遂げている。シナプスやニューロンの分子レベルでの解析、多電極アレイを用いた神経活動の記録、大規模な神経に関連する遺伝研究、言語や論理思考といった高次認知機能の研究など、研究分野は多岐に渡っている。こうした学際的なアプローチにより、BSIの研究者たちは、脳の発生、その構造や機能に関する新たな発見をし、またアルツハイマー病のような神経変成性疾患や統合失調症などの精神疾患の原因となるメカニズムに関する新たな知見を得ることに成功してきた。
増大する知識とコネクション
胎児の脳の発達は複雑で高度に統合されている。樹状突起や軸索をのばして非常に正確なつながりを形成する前に、何十億ものニューロンは発生途中の組織の中を移動している。このようなプロセスの大部分は生後に起こり、感覚情報に大きく依存している。
脳の発生についての理解に関し、BSIの研究者たちの貢献は大きい。最近、樹状突起が正しい進行方向を決定するのに関わる分子の正確な役割を明らかにした1。また、BSIでは生化学的、分子生物学的な分析により、神経回路の形成に関わる鍵となるシグナルが同定されている。さらに、これらの技術と遺伝子改変技術を組み合わせることにより、特定のタイプの細胞や神経回路における遺伝子の働きを操作することが可能になった。一方で2光子顕微鏡を用いたカルシウムイメージング法を用いれば、生きたままの脳組織の神経活動を可視化できる2。このようにして、研究者たちはそれぞれの分子が脳の発生に果たす役割を明らかにしている。
ニューロンの軸索伸張やその誘導に影響を与えるような分子機構を解明することにより、脊髄の損傷後、なぜニューロンの修復がおこらないのか、ひいては、なぜ運動能力や感覚機能が回復しないのか、についての理解が進むだろう。
記憶に光をあてる
私たち個人のアイデンティティ形成に記憶は不可欠である。記憶の形成には脳の海馬領域に張り巡らされた神経ネットワークのなかでニューロン同士のつながりの増強が関与すると考えられている。そして、同じネットワークが再活性化されることで記憶が想起されると考えられている。
最近、脳の回路研究に使われ始めている最新かつ最強のアプローチは、オプトジェネティクスと呼ばれる技術である。この技術では、ある特定のニューロン集団の電気的活動を直接操作できるような光感受性タンパク質を、遺伝子改変動物に発現させる。光ファイバーケーブルを通し、レーザー光のパルスを当てることで、まるでスイッチをオンオフするように、標的となるニューロンの活動を活性化したり抑制したりすることができる。
理研-MIT神経回路遺伝学研究センターの研究者たちは、オプトジェネティクス技術を用いて、記憶の過程に関する研究を行なっている3。彼らは、まさに記憶が形成されている最中に活動する脳細胞のネットワーク特異的に、光感受性タンパク質を発現するマウスを作成した。このマウスを用いて、記憶を形成している最中に活動していたまさにそのニューロン群を再び活性化すると、まったく同じ記憶を思い出せることが実証された。
記憶がどのように形成され、想起されるかをさらに理解することにより、いつの日か、アルツハイマー病や記憶喪失などに苦しむ患者の脳で、これらの記憶の過程が働かなくなる原因を明らかにできるであろう。
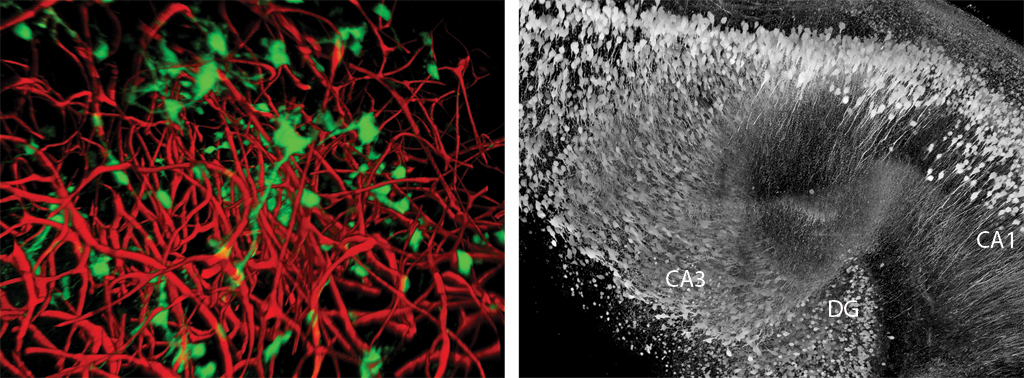
図1: 脳の中を見る。脳を透明にするScaleという試薬を用いれば、未だかつてなかったレベルの詳細さで、脳の微細な構造を観察することが可能である。その結果、例えば記憶形成の中心的構造である海馬に関して、成体のマウスにおいて(左)神経幹細胞(緑)と血管(赤)の空間的な分布を定量的に調べたり、海馬の内部構造である歯状回(DG)やCA1、 CA3領域などを再構築することができるようになった。
© 2014 RIKEN
脳の内側を覗く
精密な脳の構造には、神経ネットワークに関するヒントが隠されている。脳内の構造を「見る」ために、一般に研究者は、固定された脳の組織を蛍光性のマーカーでラベルし顕微鏡下で観察する。生物の組織は光散乱を起こすため、1ミリより深い領域には光が届かない。このため、脳のサンプルは薄いスライス状の切片にする必要がある。しかし、組織をこのようにしてスライスし、画像化し、デジタルに再構築する方法は、高い費用と多くの労力がかかる作業であり、したがって小さな体積分にしか適用できない。
より適しているのは、試料全体の形やプロポーションが変わることなく、また蛍光マーカーによるシグナルの減衰もなく、脳組織を完全に透明にして観察できるような方法である。BSIの研究者たちは、この方法をScale(スケール)という試薬を開発することで成し遂げた。これは切片を作成することなく、前例のないほどの深い位置でラベルされた細胞を可視化できる方法だ4(図1)。この革新的技術を使って、科学者たちは細胞内構造レベルの解像度で神経ネットワークを再構築でき、脳回路に関する見識を深めることができる。
また、生きた脳内の回路の機能についても研究することも可能だ。BSIの研究者たちは、物の認識や、意思決定、合目的行動などの高次脳機能を、ヒト以外の霊長類において、特定の神経回路をブロックしたり、単一ニューロンを記録したりしながら、おのおのの構成要素がどのようにタスクの遂行に寄与しているのかを研究している。
脳の構造、回路とその高次機能に対する理解が深まれば、多くの応用の可能性が生まれるだろう。例えば、世界中で、麻痺のある患者が義肢を動かすことができるようなインターフェースの開発が進んでいる。現段階では、そのような機器のほとんどは脳へ直接移植が必要なため侵襲性があり、また一生涯使えるものではないが、BSIの研究者はより安全かつ長期的にこれらの技術を応用できるような開発に成功している5。
脳研究の発展によって、この複雑なる臓器への私たちの理解が深まるだけでなく、その知識を応用することで、神経障害や神経障害を患う何百万もの患者たちにより効果的な治療を提供することができるであろう。脳は、ヒトにおける学習という活動の中心にあり、私たちのアイデンティティを形作る臓器である。脳機能の研究は私たちに、人間であることの意味について新たな見識を与えてくれるに違いない。
References
- Liu, X., Ramirez, S., Pang, P. T., Puryear, C. B., Govindarajan, A., Deisseroth, K. & Tonegawa, S. Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature 484, 381–385 (2012). doi: 10.1038/nature11028 (Link)
- Hama, H., Kurokawa, H., Kawano, H., Ando, R., Shimogori, T., Noda, H., Fukami, K., Sakaue-Sawano, A. & Miyawaki, A. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience 14, 1481–1488 (2011). doi: 10.1038/nn.2928 (Link)
- Matsui, A., Tran, M., Yoshida, A. C., Kikuchi, S. S., U, M., Ogawa, M. & Shimogori, T. BTBD3 controls dendrite orientation toward active axons in mammalian neocortex. Science 342, 1114-1118 (2013). doi: 10.1126/science.1244505 (Link)
- Aoki, T., Kinoshita, M., Aoki, R., Agetsuma, M., Aizawa, H., Yamazaki, M., Takahoko, M., Amo, R., Arata, A., Higashijima, S. et al Imaging of neural ensemble for the retrieval of a learned behavioral program. Neuron 78, 991-894 (2013). doi: 10.1016/j.neuron.2013.04.009 (Link)
- Chao, Z. C., Nagasaka, Y. & Fujii, N. Long-term asynchronous decoding of arm motion using electrocorticographic signals in monkeys. Frontiers in Neuroengineering 3, 3 (2010). doi: 10.3389/fneng.2010.00003/full (Link)
This article originally appeared online in the RIKEN Research Perspective of RIKEN Research on April 4, 2014. (Link)