|
 |
 |
 |
第二期ニューロン機能研究
|
ニューロン機能研究グループ
グループディレクター
Takao K. Hensch |
|
 |
ニューロンの機能についての多くの知識は、生物物理レベルや分子レベルで単独の細胞を詳細に研究することにより得られてきた。しかしながらニューロンはシナプスを介した神経回路網を構築することによって初めてその機能を発現する。BSIのニューロン機能研究グループは第一期研究において、細胞神経生物学とシステム神経生物学の境界に焦点をあて、独創性に富む研究を行ってきた。その結果
、嗅覚(森憲作チームリーダー、吉原良浩チームリーダー)、小脳(狩野方伸チームリーダー、矢野良治チームリーダー)そして視覚(Takao
K. Henschグループディレクター)の分子・細胞・システムレベルでの理解に多大な進歩がもたらされた。私たち研究グループの特徴は、従来用いられてきた電気生理学や解剖学の技術を最新の遺伝子工学的手法と組み合わせたことにある。第二期研究では、神経回路に特定の機能を与える細胞間相互作用をさらに詳しく研究し、新たな概念・法則の発見を目指す。
|
 |
| 嗅
覚 系 |
|
機能分子研究チームの森チームリーダーらは、匂い情報の脳内表現メカニズムの解明を目指し、電気生理学的手法とイメージング技術を駆使することによって、嗅球(匂い情報が最初に伝達される脳の部位
)における匂い分子マップの存在を見い出し、その機能的意義を明らかにした1)。マウスの鼻腔に存在する個々の嗅細胞(匂い分子を受容するニューロン)は、ゲノム上に存在する約1,000種類もの匂い分子受容体レパートリーの中からたった1種類を選択することによって、特定の匂い分子にのみ反応するようになる。同じ匂い分子受容体を発現した嗅細胞は、嗅球に存在する約1,800個の糸球のうち特定の2つの糸球に軸索を投射し、そこで2次ニューロンの樹状突起とシナプス結合を形成する。最も重要な問題は、このように正確な配線機構がどのようにして確立され、維持されるのかということである。シナプス分子機構研究チーム(チームリーダー:吉原良浩)ではこの問題に2つの戦略で取り組んでいる。
第一に、嗅細胞の軸索を嗅球の特定の領域にガイドするために機能する細胞認識・接着分子の同定である。これまでに、吉原チームリーダーらは、嗅覚神経系においてユニークな発現パターンを示す数種の新規分子(OCAM,
BIG-1, BIG-2, telencephalin)を同定し2)、現在、分子細胞生物学的・生化学的および発生工学的手法により、これら細胞接着分子の機能の解明に取り組んでいる。またゼブラフィッシュにおける変異体スクリーニングによって、嗅覚神経系の形成に重要な役割を果
たす機能分子の発見も目指している。

画像をクリックすると拡大します。
図1 WGAトランスジーンを用いての選択的神経回路可視化技術
特定のニューロンだけで機能するプロモーターの支配下にWGA遺伝子を限局して発現させることによって、そのニューロンを起点とする神経回路のみを選択的にかつ再現性良く可視化することができる。
|
第二に、この研究室で開発された革新的な神経回路トレーシング技術は、より高次の脳における特定の匂い情報の表現パターンを可視化することを目的としている3)。経シナプス性トレーサーである小麦胚芽レクチン(WGA)の遺伝子を特定のタイプのニューロンにおいてのみ発現するトランスジェニックマウスを作製することによって、そのニューロンに起因する神経回路を選択的にかつ再現性良くラベルすることができる(図1)。ある1種類の匂い分子受容体を発現する嗅細胞のみでWGAを発現させることにより、鼻から脳への特定の匂い情報の流れを可視化できると期待され、匂いと脳の高次活動を結びつける機能地図の完成へと向かう。
|
| 視
覚 系
|
画像をクリックすると拡大します。
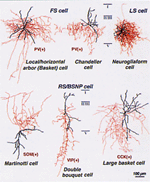
図2 大脳皮質の抑制性ニューロンタイプの軸索(赤)と樹状突起(黒)の形態
(岡崎生理学研究所、理化学研究所バイオ・ミメティックコントロール研究センター 川口泰雄チームリーダーより提供)
|
視覚系における神経回路は比較的長い研究期間にもかかわらず明らかではない。大脳皮質視覚野における興奮と抑制の最適バランスが大きさ、方位
、方向の優先などの受容野の特徴性を決定するようである。神経回路発達研究チーム(チームリーダー:
Takao K. Hensch)は生後発達初期のバランスの変化に注目している。40年以上前にHubelとWieselによって初めて詳述された視覚経験に対する可塑的変化は、抑制性シナプスによって駆動されることがわかった。
GABA合成酵素のシナプス特異的アイソフォーム(GAD65)欠損マウスでは、野生型マウスで見られるような眼優位
可塑性(単眼遮蔽後に開いている目に優位になるような皮質反応性の変化)が検出されない4)。しかしながら単眼遮蔽の間、ベンゾジアゼピンでGABA作動性の伝達を局所的に高めると、眼優位
可塑性は完全にレスキューされる。これらの結果により、単独のシナプスよりむしろ皮質内局所回路が競合する感覚入力の差を探知し、視床−皮質および皮質間の神経回路における変化をもたらすことが明らかとなった。
大脳皮質視覚野において、重篤ではあるが回復可能な可塑性の撹乱を示す動物モデルは、経験に依存する脳の変化のメカニズムを分析する貴重な手段となる。今後、生体内でどの神経回路要素が特に可塑的変化に重要であるかを明らかにするため、皮質内の抑制性介在ニューロンの多様性に焦点を絞った研究を行う。さらに理化学研究所ゲノム科学総合研究センターなどの他の研究機関との密接な共同研究を通
して、適切な興奮―抑制バランスによって可塑性が活発になる時に起こる一連の現象がきっと解明されるだろう(図2)。
|
神経回路の機能のための臨界期
画像をクリックすると拡大します。
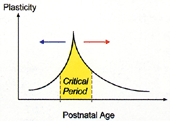
図3 発達期の視覚回路は視覚経験によって形作られる。眼からの入力による視覚回路の発達は、生後の限られた時期(臨界期)にしか起こらない。皮質の抑制性を早期に高める(青矢印)、あるいは、低レベルに保つこと(赤矢印)により、それぞれの臨界期(黄色部分)の時期を早めたり、遅らせたりできる。
|
嗅覚と視覚は感覚神経回路の精巧さの点において両極をなしている。嗅細胞は変性・再生を繰り返すユニークなニューロンであり、それらは常に嗅球内の正しい位
置の標的糸球に軸索を投射しなければならない。一方、大脳皮質視覚野への左右両眼からの入力は生存中一度だけ空間を争う。なぜ一方の系は継続的に可塑的であり、他方は固定されているのか。この二極性の基本機構の理解は、基礎神経科学の社会への最大の貢献の1つとなる。つまり脳を適切に成長させる方法の解
明へとつながる。
上記のGAD65変異体における眼優位可塑性のレスキューは、臨界期のピークのみならず、成体になってからでも可能である5)。これとは逆に野生型マウスにおいて、ジアゼパムによって大脳皮質視覚野における可塑的変化の開始を早めることができた。これは臨界期のタイミングを直接制御できた最初の事例であり抑制性ニューロンが鍵を握っている(図3)。興味深いことに、嗅球におけるGABA作動性顆粒細胞は継続的に作られており、嗅覚系においても抑制性ニューロンが可塑性に一役を担っていると考えられる。
第二期研究では、別の感覚経路の研究をする新たなチームを私たちのグループに迎えたい。例えば、聴覚系や体性感覚系における神経回路を精巧にするための抑制性ニューロンの役割や臨界期についての研究は興味深いものである。さらに個体レベルでの感覚についての研究のみならず、細胞レベルの分析も重要である。例えば多様な興奮性と抑制性が存在する微小神経回路に導入されたときニューロンはどのように反応するだろうか。さらには多様なタイプの抑制性介在ニューロン間での相互作用はどうか、そしてこの相互作用はどのような機能(例えば、同期性発火や振動)を回路に与えるのだろうか。in
vitroで局所的神経回路の活動を高解像度で解析する第4のチームも必要である。
この2つの分野に興味のある優秀な研究者に、チームリーダーとして応募される事を推奨する。応募締め切りは2001年3月15日。BSIの多くの研究室で小脳について精力的に研究されているのと同様に、現在
私たちは神経回路の統合の結果
、知覚ニューロン機能がどのように現れるかを理解する事に全力をあげている。月ごとのグループ集会、親密な協力、著名な国際的科学者たちを招き毎年開催されるワークショップなどが、私たちの探求を導いてくれるだろう。第1回目のワークショップは、「Cellular
Interactions in Neuronal Networks」というタイトルで、2001年4月3日〜5日に行われ、Y.
Amitai, E. Buhl, E. Callaway, B. Connors, M. Kano, Y. Kawaguchi, A. Konnerth,
T. Manabe, I. Mody, S. Nelson, M. Scanziani, R. Yuste, R. Wong が特別参加する。和光でお会いしましょう。(詳しくはsearch14@brain.riken.go.jpを参照)
<References>
1) Uchida, N., Takahashi, Y.K., Tanifuji, M., Mori, K. (2000) Odor maps in the
mammalian olfactory bulb: domain organization and odorant structural features.
Nat Neurosci. 3:1035-1043 2) Mori, K., Nagao, H., Yoshihara, Y. (1999) The olfactory
bulb: coding and processing of odor molecule information. Science 286:711-715
3) Yoshihara, Y., Mizuno, T., Nakahira, M., Kawasaki, M., Watanabe, Y., Kagamiyama,
H., Jishage, K., Ueda, O., Suzuki, H., Tabuchi, K., Sawamoto, K., Okano, H., Noda,
T., Mori, K. (1999) A genetic approach to visualization of multisynaptic neural
pathways using plant lectin transgene. Neuron 22:33-41 4) Hensch, T.K., Fagiolini,
M., Mataga, N., Stryker, M.P., Baekkeskov, S., Kash, S.F. (1998) Local GABA circuit
control of experience-dependent plasticity in developing visual cortex. Science
282:1504-1508 5) Fagiolini, M., Hensch, T.K. (2000) Inhibitory threshold for critical-period
activation in primary visual cortex. Nature 404:183-186 |
|
| 
|
 |
 |
|
|