 |
はじめに
プログラム細胞死(“アポトーシス”として呼ばれることが多いが、発生生物学や無脊椎動物の遺伝学からこの分野に入った研究者は好んで“プログラム細胞死”の方を使う)は、余分にできた細胞を除去する、多細胞生物が発達させた普遍的な仕組みです。プログラム細胞死の役割は、形態形成については「彫刻家が丸太にのみを振るって形を作っていく作業」に例えることができます。しかしこの現象が特に多く観察されるのが、細胞の多様性を特徴とする神経系と免疫系といった、形態形成とはあまり関係のない組織であることは注目に値します。神経系に関してみると、発生初期には形態形成と直接関係する細胞死もありますが、それ以降は多様な性質も持った神経細胞集団からの細胞選択機構であるといえるわけです。神経系の発生では以下のステージでの細胞死が知られています。
1.神経系初期発生にみられる細胞死
神経誘導を受けた神経板は、形態形成運動を起こし神経管を形成します。その際に神経上皮の融合が起こりますが、その融合面
で細胞死が観察されます。
2.脳室周囲層での細胞死
中枢神経系では胎児期に脳室に近い細胞が盛んに細胞分裂を繰り返し、脳になるすべての細胞を作り出しますが、この細胞集団で大量
の細胞死が観察されます。
3.シナプス形成に伴う細胞死
神経回路網を作るステージになると、標的と適切なシナプスを作れた細胞は生存維持されますが、それ以外の神経細胞は細胞死によって除去されてしまいます。
4.神経変性に伴う細胞死
神経回路網形成に寄与している成熟神経細胞は、その後細胞分裂することなく生涯にわたって生き続けます。この神経細胞の長寿を支えるために、その10倍以上のグリア細胞が活躍しているわけですが、それでも加齢とともに一部の神経細胞は死んでいきます。その数は、ヒトでは一日10万個に達するといわれています。これは健常なヒトでの話ですが、アルツハイマー病やパーキンソン病などの神経変性疾患に羅患すると、脳の特定部位
の神経細胞死が加速されて重篤な神経症状を発症するようになります。私たちの研究室では、神経細胞死のメカニズムを明らかにすることによって、その生物学的な意義と神経変性を抑制する方法を探る研究を進めています。
画像をクリックすると拡大します。
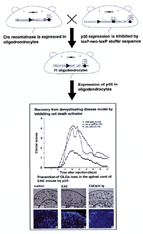
図1 オリゴデンドロサイトでリコンビナーゼを発現するマウスと、loxP-p35マウスとを交配することによって、オリゴデンドロサイトで特異的にDNA組み換えを起こさせてp35を発現させた。p35発現マウスでは実験的自己免疫性脳脊髄炎(EAE)の発症と脱髄の抑制が観察された。
|
線虫の遺伝学から始まった細胞死の分子遺伝学
すべての細胞系譜が明らかになっている線虫(C.
elegans)は、細胞死研究に画期的な進展をもたらしました。1090個の体細胞が発生過程で作られ、そのうちの131個が必ず決まった発生ステージで細胞死によって失われていきます(この細胞死は特に神経系で多く、105個が神経系の系譜から起こります)。131個すべての細胞死が抑制される変異体(ced-3変異体)が得られたことで、プログラム細胞死を調節する遺伝子の存在が示唆されたわけです。プログラム細胞死自体は種を越えて見られる普遍的な現象ですから、ほ乳類にも同じような細胞死実行遺伝子があるに違いないと考え、私はこの分野に入っていきました。
理論的骨格
線虫の細胞死実行遺伝子ced-3が同定され、その結果をもとに最初のほ乳類細胞死遺伝子ICEの同定という、大変エキサイティングな研究を味わうことができました。その後の研究から、ICEと類似の細胞死遺伝子はカスパーゼと呼ばれる一群のプロテアーゼファミリーを形成することが明らかになってきました。カスパーゼは細胞死共通
のメディエーターと考えられますから、この活性を人為的に調節する事によって、神経変性を抑制できるのではないかと私たちは考えました。カスパーゼはほ乳類で14種知られていますが、そのほとんどを抑制するカスパーゼ阻害遺伝子がバキュロウイルスから得られ(p35遺伝子)、この遺伝子を神経組織に発現させてカスパーゼを一網打尽に抑制しようという戦略を立てました。神経軸策を取り囲む髄鞘を形成する細胞(オリゴデンドロサイト)が特異的に変性する疾患である多発性硬化症は、中枢神経系の代表的な自己免疫疾患ですがその治療法は確立していません(著名な女流チェロ奏者ジャクリーヌ・ジュプレがこの疾患で亡くなっています)。私たちはマウスの病態モデルにおいて、オリゴデンドロサイトでカスパーゼ阻害遺伝子p35を発現させることによって、その発症と進行を抑制することに成功しました(図1)。線虫から始まったプログラム細胞死を実行する遺伝子の制御機構の研究が、ほ乳類での神経変性疾患の治療法開発を可能にしたわけです。
|
|
画像をクリックすると拡大します。
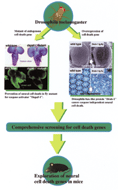
図2 カスパーゼ活性化因子Apaf-1の変異体では、幼虫脳の肥大と細胞死抑制が観察された。一方、細胞死促進因子Bax型Bcl-2ファミリー遺伝子Drob-1の複眼での過剰発現は神経変性を引き起こした。ショウジョウバエから細胞死遺伝子を網羅的に同定し、その知見をマウス神経細胞死の理解に結びつける研究戦略をとっている。
|
遺伝学からの神経細胞死へのアプローチ
プログラム細胞死も神経変性もこれが実行されている場は、脳という複雑な細胞社会です。脳で起こる細胞死を調節する因子の探索は、生体での表現型を指標にした遺伝学的なスクリーニングによって行うのが理想的です。この目的のために私たちはショウジョウバエをモデル生物として用いています。この動物は発生遺伝学的な研究に適し、ゲノムプロジェクトが終了したことによって、遺伝学的スクリーニングによって得られた変異体での原因遺伝子を特定することが迅速に行えるようになってきました。さらに特筆すべきは、ヒトの神経変性疾患に類似したモデルを作ることができ、ほ乳類では困難な、発症に時間のかかる神経変性疾患の遺伝学的な研究をショウジョウバエを用いて行えるのではないかとの期待がもたれていることです。今までの私たちの研究によって、カスパーゼの活性化機構が、ヒトとショウジョウバエで保存されていることが明らかになり、特に発生初期の未分化な神経細胞死の調節にApaf-1と呼ばれるカスパーゼ活性化因子が重要な役割を果
たすことが明らかになりました(図2)。ほ乳類での細胞死誘導に重要な役割を果たすBcl-2ファミリー遺伝子BaxのショウジョウバエホモログDrob-1は、カスパーゼ非依存的に神経細胞死を誘導することがわかりました(図2)。カスパーゼ非依存的な細胞死はさまざまな局面
で神経変性に関与することが示唆されていますが、その遺伝的な制御機構はまったく不明であり、私たちはその遺伝学的な解明を目指しています。
ゲノムプロジェクトの完了は、ショウジョウバエでの細胞死遺伝子の網羅的な探索を可能にします。未だ明らかにされていない神経細胞死実行機構の全貌をショウジョウバエを用いて遺伝学的に探索し、その知見をヒトの神経細胞死の理解と神経変性疾患の新たな治療法の開発へと積極的に結びつけるために、マウスを用いた研究を同時に行っています。私たちはこのような研究戦略によって神経細胞死・神経変性の理解と修復を目指しています(図2)。
|
|
 |
|
 |
|
|
|
|

 |
|

