 |
 画像をクリックすると拡大します。
画像をクリックすると拡大します。
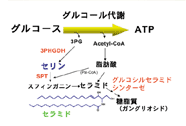
図1 脳におけるグルコース代謝
画像をクリックすると拡大します。
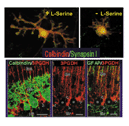
図2 培養プルキンエ細胞における培地中のセリンの影響(上段)と小脳組織におけるセリン合成酵素、23PHGDHの発現パターン(下段)。 |
なぜセリン研究か?
一般の神経細胞は、一端分化すると再び細胞分裂する能力を失い、その代わりに個体死を迎えるまで生存する能力を有しています。したがってヒトの場合、80年以上も生き続けて活発に神経活動を営んでいることになりますが、なぜこのようなスーパーパワーを神経細胞が備えているのかとても不思議なことです。ところで、神経細胞が生きていくうえで必須な化合物を挙げなさいと問われれば、誰もが真っ先にグルコースと酸素であると答えるでしょう。神経細胞は、その活動を営む上でATPに完全に依存しており、グルコースと酸素はもっぱらATP産成に使われます。しかしグルコースの約3割は、ATP産成以外にも利用されています(図1)。私たちの研究室では、神経細胞の持つこの生物特性の物質的基盤を明らかにするために、解糖系の中間産物、3-ホスフォグリセリン酸から合成されるセリンに着目して研究を進めています。結論から言うと、非必須アミノ酸に属する陳腐な化合物であるセリンは、神経細胞の発達、生存、形態形成に必須のアミノ酸であることを見出しました。驚いたことに、グルコースからのセリン合成はもっぱらグリア系の星状細胞(アストロサイト)で行われていました。では、何故、斯くも神経細胞にとってこの甘いアミノ酸は重要なのでしょうか?私たちはセリンから合成されるスフィンゴ脂質に、その解答の一つを求めています。セリン代謝から垣間見られた神経細胞とグリア細胞との動的相互作用こそが、神経細胞の長期生存のパワーの謎を解く鍵であることがわかってきました。
脳におけるセリン代謝のユニーク性
1998年、私たちは海馬神経細胞の培養過程で、培地中にセリンあるいはグリシンが欠けていると、細胞の形態不全と生存数の激減することを見出しました。セリン要求性は、海馬のみならずプルキンエ細胞でも観察され、また、両アミノ酸に特異的であり光学異性体であるD体セリンには、こうした活性はまったく見られません。なぜセリンに生存維持活性があるのかを知るために、セリン合成に関わる鍵酵素である3PHGDH(3ホスホグリセリン脱水素酵素)の発現を調べてみると、本酵素蛋白の発現が神経細胞で極端に低下しているのに対し、周囲にある星状細胞では極めて強いことがわかりました(図2)。この結果は、神経細胞は自分でセリンを合成する能力に乏しく、もっぱらグリア細胞からの供給に依存していることを示唆しています。脳組織における3PHGDH遺伝子のこのような細胞特異的な発現機構の解明が待たれます。
セリン由来のスフィンゴ脂質によるシグナリングとミクロドメイン形成
神経細胞の生存にとって何故セリンが格別に重要なのでしょうか?グリア細胞から積極的に放出されるセリンは、おそらく中性アミノ酸のトランスポーターを通じて神経細胞に取り込まれ、いろいろな生体分子の合成に利用されます。私たちが現在注目しているのは細胞膜に存在しているスフィンゴ脂質です。脳にはスフィンゴミエリンとガングリオシド等の糖脂質が特に豊富に含まれています。スフィンゴ脂質合成は、セリンパルミトイル転移酵素(SPT)によるセリンとパルミトイルCoAの縮合反応からスタートします。したがって、神経細胞内のセリンの枯渇はスフィンゴ脂質量の低下を招き、最終的に細胞死に至ると考えられます。それでは、スフィンゴ脂質の低下がどのような機構により神経細胞死が導かれるのでしょうか?
スフィンゴ脂質は主に2つの特徴的な機能を持っていると考えられています。1つは、この脂質自身が、細胞の生存と死に関わるシグナル分子であることです。2つ目は、スフィンゴ脂質はコレステロールやGPIアンカー型の糖蛋白と集合体を形成し、細胞膜上でラフトとよばれるミクロドメインを形成することです。ラフトは、細胞外情報の受容と発信の基地として、あるいはアミロイド蛋白のプロセッシングの場として重要な機能を演じていると考えられています。したがって、このような重要な機能を持ったスフィンゴ脂質の減少は、神経細胞の生存を脅かす程のダメージを与えると想像されます。しかし、正確な細胞死のメカニズムは今後の研究を待たねばなりません。
多細胞系での機能解析:組織特異的ノックアウトマウスを作る
画像をクリックすると拡大します。
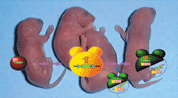
図3
Cre/LoxP組み替え系による組織特異的ノックアウトマウスの作成
 画像をクリックすると拡大します。
画像をクリックすると拡大します。
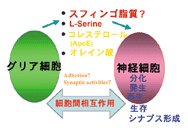
図4
神経細胞とグリアの相互作用により神経細胞の分化、形態形成、シナプス形成等が支配されている。この相互作用をメディエイトしている化合物は、従来から知られていた平凡なものである。 |
実際の生体内においてもセリンやスフィンゴ脂質は神経細胞の生存因子として機能しているのでしょうか?この疑問に答えるために、セリン合成酵素およびスフィンゴ脂質合成に関わる鍵酵素、3PHGDHとSPTのノックアウトマウスを作ることが確実な証明法であると考えられます。両者の遺伝子とも胎生致死性の遺伝子である可能性が考えられたので、組織特異的なノックアウトマウスを作る戦略を導入しました(図3)。現在、皮膚とT細胞特異的なスフィンゴ脂質欠損マウスを作ることに成功したので、今後各組織でのスフィンゴ脂質機能の解析が可能となってきています。
ところで、最近「Science」に、脳の脂質の機能に関し、極めて興味深い報告がなされました。グリア細胞が放出するコレステロール/アポEが、シナプス形成と維持に極めて重要であることが示されたのです。スフィンゴ脂質もグリアから放出され、神経細胞に何らかのシグナルを送っているのでしょうか?あるいは逆に、神経細胞からの因子がグリアの活動や機能に影響を与えているのでしょうか(図4)?私たちのノックアウトマウスは、神経細胞内のみならず細胞外からのセリンや脂質の働きを知るうえでも、極めて重要な情報を与えてくれるものと期待しています。
おわりに
ヒトのゲノムシークエンスの解読が完了し、遺伝性疾患の原因遺伝子の同定が急ピッチで進められています。3PHGDH遺伝子変異によるセリン欠損症(West症候群の一例)、スフィンゴ脂質合成酵素遺伝子変異による家族性神経変異疾患(HSN-1)の発見が相次ぎ、マウスのみならずヒト脳においてもセリン代謝が極めて重要であることが示されています。神経細胞のみならず、グリア細胞をも含めた脳研究の展開により、脳への理解(脳を知る)がいっそう深まるとともに、ヒトの脳の各種疾患への予防や治療、機能維持の新たなる手段(脳を守る)を提供してくれるものと期待しています。
なお本研究は多くの方々の協力を仰ぎました。以下の参考論文を紹介することにより、感謝の意の代わりとさせてもらいます。
<References>
1) Mitoma, J., Furuya, S., and Hirabayashi, Y.: A novel metabolic communication
between neurons and astrocytes: A non-essential amino acid L-serine released by
astrocytes is essential for developing hippocampal neurons (1998) Neurosci. Res.
30, 195-199
2) Mitoma, J., Kasama, T., Furuya, S., and Hirabayashi, Y.: Occurrence of an unusual
lipid, phosphatidyl-L-threone, in cultured hippocampal neurons: exogenous L-serine
is required for the synthesis of neuronal phosphatidyl-L-serine and sphingolipids
(1998) J. Biol. Chem. 273, 19363-19366
3) Furuya, S., Mitoma, J., Makino, A., and Hirabayashi, Y.: Ceramide and its interconvertible
metabolite sphingosine function as indispensable lipid factors involved in survival
and dentritic differentiation of cerebellar Purkinje cells (1998) J. Neurochem.
71, 366-377
4) Hirabayashi, Y., and Ichikawa: Roles of glycolipids and sphingolipids in biological
membrane; The Frontiers in Molecular Biology Series (Eds, Fukuda, M., Hindsgaul,
O., IRL press at Oxford Press) (1999) pp220-248
5) Furuya, S., Tabata, T., Mitoma, J., Yamada, K., Yamasaki, M., Yamamoto, T.,
Watanabe, M., Kano, M., and Hirabayashi, Y.: L-Serine and glycine serve as major
astroglia-derived trophic factors for cerebellar Purkinje neurons (2000) Proc.
Natl. Acad. Sci. USA., 97, 11528-11533
6) Yamazaki, M., Yamada, K., Furuya, S., Mitoma, J., Hirabayashi, Y., and Watanabe,
M.: 3-Phosphoglycerate dehydrogenase (3PGDH), a key enzyme for L-serine biosynthesis,
is preferentially expressed in the radial glia/ astrocyte lineage and olfactory
ensheathing glia in the mouse brain.(2001) J. Neuroscience 21, 7691-7704
 |
| |
 |
|
|
|
|

 |
|

