 |
私たちは2000年9月に当研究室を開設して以来、分子から疾患に到るいくつかの分野の研究プロジェクトに取組んでいます。私たちの研究テーマは「シナプス可塑性」と「興奮性アミノ酸性シナプス伝達」という2つのキーワードに集約することができます。
 画像をクリックすると拡大します。
画像をクリックすると拡大します。
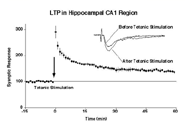
図1 海馬CA1領域のLTP
画像をクリックすると拡大します。
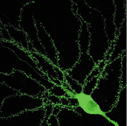
図2 CA1錐体細胞の樹状突起スパイン。微小な点がスパイン。 |
シナプス可塑性の分子メカニズム
哺乳類の海馬では、入力繊維の短時間のテタヌス刺激によって、興奮性シナプスの伝達が長期間にわたり増強されます(図1)。この現象(long-term
potentiation, LTP)は学習と記憶に関する細胞・シナプスモデルとしてかねてから幅広く研究されてきました。これまでには海馬CA1領域のLTPには、シナプス後部のNMDA受容体の活性化とその結果としてCa2+イオンの流入を必要とするということが明らかにされてきました。その結果、さまざまなタンパク質リン酸化酵素がCa2+依存に活性化され、最終的にはAMPA型グルタミン酸受容体によるシナプス伝達が増強されます。しかし、このような伝達の増強がどのようにして起こるのかまだ十分に解明されてはいません。私たちは、LTPの誘導に伴いAMPA受容体がシナプス外部からシナプス後部位に移動することで、AMPA受容体伝達が増強されるのではないかと考えました。これを実験的に証明するため、GFPあるいは電気生理学的に標識したAMPAレセプタ分子を用いて実際にAMPA受容体分子がシナプスへ移行するという事実を見いだしました。
一方、酵母2-ハイブリッド・スクリーニング法がシナプス後部の蛋白の同定に利用されるようになり、興奮性シナプスの直下には蛋白間相互作用の複雑なネットワークが存在することが明らかとなりました。このネットワークの構造は強固ではなく、むしろさまざまな刺激によってダイナミックに変化します。したがって、このネットワークに埋め込まれているAMPA受容体自体もネットワーク全体の運動と連動している可能性が高いと私たちは考えています。私たちの研究プロジェクトの主な目的は、LTPにおけるAMPA受容体の運動を制御する蛋白の相互作用を解明することです。そのために、グルタミン酸受容体結合蛋白の生化学的な同定を試みています。一方でグルタミン酸受容体やその結合蛋白の変異体の構築してニューロンに導入し、それらのニューロンから電気生理学的記録を行うなど総合的な戦略を用いています。
スパイン形成分子のメカニズム
スパインは、海馬錐体細胞の興奮性シナプスの主要な形成部位です(図2)。その独特の形状が記述されたのは19世紀のことですが、それがどのように形成され、その数や形がどのようにして決まるかといった点についての理解はまだ十分とはいえません。その主因は、小ささが所以する構造を分析する上での技術的な難しさがあるためです。しかし、二光子顕微鏡をはじめとする最近の画像技術の進歩によって、生きたニューロンのスパインを可視化できるようになりました。
スパインの数と形状は、形成過程におけるシナプスの活動によって決まります。生後二週までは海馬CA1錐体細胞には、糸状側枝と呼ばれる通常のスパイン構造より細長い構造が主で、典型的なスパインはほとんど存在しません。この後、頭部と頚部を有する典型的なスパインが形成されてきます。またさらにLTPを誘導するテタヌス刺激によっても新しいスパインが形成される事が知られています。私たちは、スパイン形成のメカニズムを理解するために、スパインに認められるさまざまな蛋白を表現させて、スパインが形成されるかどうか、あるいはスパインの形態が変化するかどうかを観察しています。そのため、緑色蛍光蛋白(GFP)を神経細胞に発現した上で二光子顕微鏡という特殊な顕微鏡で観察しています。GFPが発現しているニューロンでは、GFPが細胞質を満たしてまるで生きたままゴルジ染色体を行ったように、スパインを含む微小な構造が描写されます。また、機能的な側面を評価するために、電気生理学的記録およびCa2+imagingをGFP
imagingとを組み合わせています。
画像をクリックすると拡大します。
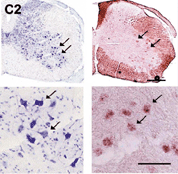
図3
運動ニューロンにおけるNR3Bの特異的表現。左:
ニッスル染色。全てのニューロンが染色されている。右: in situハイブリダイゼーション。矢印は運動ニューロンを示す。 |
シナプスを理解するための構造生物学的方法
シナプス蛋白の生物物理的特性を別な面から理解するために、これらの蛋白の三次元構造を解明することを試みています。さまざまなシナプス後部蛋白を大量の大腸菌に表現して、それらを精製して結晶化させ、その構造をX線解析によって分析しています。この方法は、上記の機能的アッセイ法を補い合うもので、例えば、生理学的な実験で蛋白の機能ドメインが同定できれば、そのドメインの構造解析を行う事が可能です。逆に構造解析から機能的重要性が示唆されれば、その部位を用いて生理学的分析を進めるために変異体を作ることもできます。
成体における神経細胞新生の学習と記憶への役割
海馬の興味深い特長として、成体においても神経細胞が継続的に新生されることがあげられます。例えば動物を豊かな環境に置くと(隠れる場所を与えた場合など)、そのような新生が促進される事が知られています。同様な所見が嗅球においても見られます。が、新たに発生したニューロンが実際に神経回路を形成し学習と記憶に影響することが直接的に証明されているわけでありません。この点についての試験を行なうために、現在、細胞障害性物質を注入することによって神経幹細胞を取除くことができる遺伝子導入モデル動物を作成しています。このモデル動物を使って、Morris水迷路試験や妊娠阻止のような試験で記憶学習に神経細胞の新生が必要かどうかを調べていきます。
私たちの知識の臨床医学への応用
最近、ヒトおよびマウスのゲノムにグルタミン酸受容体サブユニットNR3Bを新たに同定しました。このNR3Bは、脳幹と脊髄の体性運動ニューロンに非常に限局して発現していることが判りました(図3)。このように限局した発現であるため、私たちは、この遺伝子が筋萎縮性側策硬化症(ALS)に代表される運動ニューロン疾患に関係しているのではないかといった点に着目しました。
世界で350,000人にのぼる人々がALSなどの運動ニューロン疾患に罹っており、毎年100,000人もの人々が死亡しています。患者は、脊髄運動ニューロンの変性によって筋肉の制御機能を失い、呼吸不能に陥るためついには死に到ります。ALS患者全体の90%は突発性、10%が家族性で、家族性ALS患者の一部には、フリーラジカルO2をH2O2に変換する酵素、細胞質Cu/Znスーパーオキシドジムスターゼに突然変異体を有する場合があります。ですが、それは家族性ALS患者のわずか15-20%に過ぎず、それ以外の家族性患者や大半の突発性患者の病因についてはまだ解明されていません。私たちはSODの突然変異に帰すことのできない家族性ALS患者について、NR3Bの突然変異によって説明できるのではないかと考え、現在、ALS患者から採取したDNAサンプルの塩基配列を調べています。これは、ALSやその他の運動ニューロン疾患の病因、あるいはニューロン変性疾患全体に関する病因を解明する手立てとなるかもしれません。
|
|
|
|

 |
|

