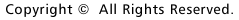|
画像をクリックすると拡大します。
図1 |
私達のチームのおもなテーマは筋萎縮性側索硬化症(ALS)とパーキンソン病の病因解明と治療法の開発です。ALSは全身の筋肉を支配する運動神経細胞が変性し、死滅してしまう病気で、身体の自由がきかなくなり、通常は発症後数年で人工呼吸器の補助なしには生きていけなくなります。あまりに気の毒な経過をたどるため、ALS患者を受け持った医師は必ず「この病気を何とかしなければ。」との思いに駆られます。パーキンソン病もALS
と同じく運動機能が障害される病気ですが、この場合はドーパミン神経という運動の中枢的なコントロールに関わる神経細胞が死んでしまうため、運動が緩慢になったり、転びやすくなるなどの症状が出現し、末期には寝たきりの生活を余儀無くされます。パーキンソン病は65歳以上の方が1%以上罹患する比較的ポピュラーな病気で、社会の高齢化が進むにつれ、ますます深刻な問題になることが確実です。
ALSもパーキンソン病も普通は非遺伝性で、「神経変性疾患」といわれる病気に属します。神経変性疾患は、ひとむかし前の教科書によれば「原因不明で、多くは成人以降に徐々に発症、進行し、病理学的には神経の特定の系に神経細胞や線維の変性脱落を生じる遺伝性または非遺伝性の疾患」(柳澤信夫氏の定義を一部改変)の総称で、端的にいえば「全くわけがわからない難病」ということになります。20年も前のことになりますが、私が医学部の最終学年のときに神経内科の臨床講義でハンチントン病という遺伝性の神経変性疾患の患者さんのビデオを見せてもらったことがあります。ハンチントン病は別名舞踏病ともいわれ、手足が勝手に踊りを踊るように動いてしまうのが主な症状です。私はこのときすでに神経内科に進路を決めていましたが、講義のあと、のちに優秀な外科医となった親しい同級生から「あんな難しい病気を治せるようになると思っているのか?」と半ばあきれたような口調で聞かれたことを今でもよく覚えています。これに対し、神経変性疾患の原因は必ず解明できるはずであり、原因がわかれば治療法も見つかるはずだという、当時は希望的観測としか言い様のない予測を口ごもりながら話したように思います。
画像をクリックすると拡大します。
図2
画像をクリックすると拡大します。
図3 |
この20年のめざましい神経変性疾患の研究の歴史を振り返ると、結果的に私の心もとない予想は大きくは外れていませんでした。研究の急速な進展の鍵は遺伝学にありました。神経変性疾患の原因が不明といっても遺伝性の疾患に限れば、その原因が遺伝子にあるのは明らかです。私が大学を卒業する頃、神経変性疾患としてははじめてハンチントン病の遺伝子座が決定され、その後今日までに主な遺伝性神経変性疾患の原因遺伝子があらかた同定されました。その成果をもとに病因遺伝子の機能解析がすすめられた結果、ふたつの重要な発見がありました。ひとつは多くの遺伝性神経変性疾患が遺伝子変異によってできた異常な蛋白質が蓄積して起こることがわかったことです(図1)。
蛋白質が正常な機能を果たすためには正しく折れたたむ(フォールディングという)ことが必要ですが、変異によって形の崩れたミスフォールド蛋白質は機能を失うだけでなく、お互いにくっつきあい、塊をつくって細胞の内外に沈澱し、細胞毒性を発揮するようになるらしいのです。もうひとつの発見は、遺伝性の疾患の原因になっている遺伝子産物(蛋白質)が非遺伝性の類似疾患の原因にもなっている場合が多いことです。パーキンソン病はその良い例です。常染色体優性遺伝性パーキンソン病の病因遺伝子として最初に同定されたのは シヌクレインという蛋白質です。この遺伝病自体は世界に数家系しかない大変まれな病気ですが、じつはこの病気の遺伝子同定が頻度の高い非遺伝性のパーキンソン病の研究に大きな発展をもたらしました。遺伝子同定の直後、パーキンソン病の病理学的な特徴であるレビー小体という神経細胞内の異常凝集物の主成分が シヌクレインという蛋白質です。この遺伝病自体は世界に数家系しかない大変まれな病気ですが、じつはこの病気の遺伝子同定が頻度の高い非遺伝性のパーキンソン病の研究に大きな発展をもたらしました。遺伝子同定の直後、パーキンソン病の病理学的な特徴であるレビー小体という神経細胞内の異常凝集物の主成分が シヌクレインであることがわかったのです。現在では遺伝的、または後天的要因でミスフォールド蛋白質となった シヌクレインであることがわかったのです。現在では遺伝的、または後天的要因でミスフォールド蛋白質となった シヌクレインが神経毒性を発揮してパーキンソン病の原因となるという考えが広く支持されています。 シヌクレインが神経毒性を発揮してパーキンソン病の原因となるという考えが広く支持されています。
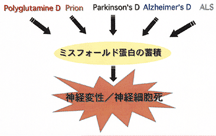
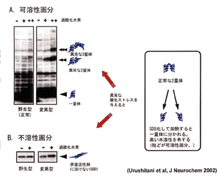
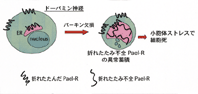
我々のチームではこのような歴史的事実を踏まえ、常染色体優性遺伝性ALSの病因となる変異SOD1と常染色体劣性遺伝性パーキンソン病(AR-JP)で欠損するパーキンの2種類の蛋白質に研究の焦点を絞っています。これまでに変異SOD1がミスフォールド蛋白質としての性質を確かに持つことを確認し、酸化的ストレスでその性質が悪化することを明らかにしました(図2)。またパーキンが蛋白質分解に関わる酵素であることを突きとめ、パーキンの欠損によってパエル受容体というミスフォールド蛋白質が蓄積し、AR-JPの原因となるという仮説を提唱しました(図3)。パエル受容体は シヌクレインが引き起こす細胞死のシグナルの下流に位置して非遺伝性パーキンソン病の病因にも関わっている可能性があるので、その経路の詳細を明らかにしようと努力しています。一方、神経変性に関わる病的シグナルを解明する研究も行っています。その過程でHtrA2という新たな細胞死誘導因子の単離に成功しました。いまは個別の疾患との関わりを調べています。 シヌクレインが引き起こす細胞死のシグナルの下流に位置して非遺伝性パーキンソン病の病因にも関わっている可能性があるので、その経路の詳細を明らかにしようと努力しています。一方、神経変性に関わる病的シグナルを解明する研究も行っています。その過程でHtrA2という新たな細胞死誘導因子の単離に成功しました。いまは個別の疾患との関わりを調べています。
今後は上記の研究を発展させるとともに、ALS、パーキンソン病の治療法の開発に本格的に取り組むことが急務です。20年前、私の同級生はとても手がつけられないと思い、私自身もいつ原因が明らかにできるか皆目見当がつかなかったハンチントン病は6年前、ミスフォールド蛋白質であるポリグルタミンの蓄積が原因であることが明らかになりました。さらにこれまでの研究で分子シャペロン、転写因子、アポトーシス阻害などによって病気が改善することがモデル動物を使って示されています。神経変性疾患の治療はもはや夢ではありません。現実の課題となった治療法開発に向けて私達のチームも全力で前進していくつもりです。
|
|
|