ベーブ・ルースと並ぶメジャーリーグ・ニューヨークヤンキースの顔、ルー・ゲーリックは、1938年に入りプレーの精彩を極端に欠き始めました。翌年、彼は『脊髄が固くなる原因不明の麻痺』である筋萎縮性側索硬化症(amyotrophic lateralsclerosis:ALS)と診断され、引退を余儀なくされます。さらに2年後、彼が37歳で他界してから約60年たった現在、ALSはルー・ゲーリック病とも呼ばれていますが、依然として有効な治療方法のない過酷な疾患であることに何ら変わりはありません。患者は進行性に全身の運動機能を消失する末期に至っても、意識清明で知的機能は保たれます。さらに、患者と家族に対して突きつけられる人工呼吸器による生命維持の選択や、それにともなうゴールのない介護が、ALSが最も容赦のない疾患といわれるゆえんです。
近年、家族性ALSの原因遺伝子の一つが、スーパーオキシド・ジスムターゼ1(superoxide dismutase 1:SOD1)であることが明らかになり、変異ヒトSOD1遺伝子を導入したトランスジェニックマウスはALS様の病像を呈することから、ALSの病態解明と治療法の開発に役立つ動物モデル(ALSモデルマウス)として利用されています。
ALSを特徴づけるのは運動ニューロンの細胞死であり、なぜ細胞が死ぬのかがこれまで研究の焦点になっています。一方、多細胞生物の発生過程において、一部の細胞は死ぬことを運命づけられており、また細胞が成熟した後にも、がん細胞や役割を終えた炎症細胞など、個体にとって有害な細胞は死ぬことによって除去されます。この細胞死はアポトーシスと呼ばれ、実行過程に働くのはカスパーゼとよばれる下等動物から高等動物まで多細胞生物において広く見られるタンパク質分解酵素群です。これまでのところ、先述のモデルマウスを用いた研究より、ALSにおける神経細胞死の一部はカスパーゼによって生じるという証拠が累積しつつありましたが、どのカスパーゼが疾患の病勢進行に関与し、治療の標的になりうるかは不明でした。
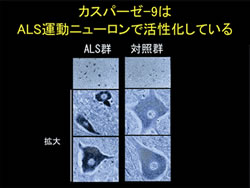
本研究では、このALSモデルマウスの脊髄運動ニューロンに、ヒトアポトーシス阻害タンパクXIAPとバキュロウイルスカスパーゼ阻害タンパクp35という2種類のアポトーシス阻害タンパクをそれぞれ導入しました。結果として、ALSモデルマウスが麻痺を発症してから死亡するまでの罹病期間は、XIAP によって延長しましたが、p35では延長しませんでした。この違いを生じたのは、XIAPによって抑制されるがp35によっては抑制されないカスパーゼ、すなわちカスパーゼ-9が病勢進行に重要な役割を果たしているからである、と考えられました。実際に、生化学的、組織学的にマウス運動ニューロンでカスパーゼ-9の活性化が確認されました。さらに、ヒトALS運動ニューロンにおいてもカスパーゼ-9の活性化を認めました(図1)。
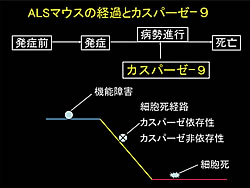
以上のことから、運動神経細胞のカスパーゼ-9の活性化抑制が、ALSの治療標的の1つになる可能性が示されました。近年、カスパーゼに依存しない細胞死の経路、あるいは、異常タンパク質の蓄積による細胞機能低下も、ALSの病態にかかわることが明らかになりつつあります(図2)。今回の研究成果を含む複数の神経変性経路を抑制する複合的、多面的アプローチによって、近い将来、ALSに対してさらに新しい有効な治療方法が開発されることが期待されます。