|
 |
はじめに
アルツハイマー博士によって、1906年に健忘を示す51歳の女性の臨床経過と病理所見が報告されました。これが今日言われているアルツハイマー病の最初の報告です。現在では同様の病理所見を持つ老人性痴呆を含めて、アルツハイマー病と総称しています。この病気は、初期には記銘力の低下から始まります。すなわち前に覚えたことを思い出せないなどです。中期になると病状は進行して認知能力が失われます。つまり今日は何月何日なのか、または今いる場所はどこなのかが分からなくなります。そして最終的には高度の痴呆状態になる病気です。発病して10年から20年かけて徐々に進行し、死に至ります。この病気は多くの場合、老年期に発症するため血管性痴呆症と並ぶ代表的な老年期痴呆症として知られており、現在日本における患者数は約60万人程度だと推定されています。残念なことに血管性痴呆症と比べ、アルツハイマー病には有効な予防法や治療手段がないというのが現状です。
アルツハイマー病では、なぜ痴呆症が引き起こされるのか?この研究の究極の目的は痴呆を引き起こす分子機構を明らかにすることです。痴呆とは、個人が獲得した知的精神的能力が失われて元に戻らない状態のことを示します。痴呆を引き起こすためには知的精神的能力を獲得していなければなりません。
しかしながら、この知的精神的能力の獲得を分子の言葉で説明しようとすると大きな問題に当たってしまいます。それはこれらの能力を獲得する分子機構そのものが、脳科学の主要な問題の1つとしていまだ解明されていないからなのです。
したがってアルツハイマー病における病態の解明は、この病気の有効な予防法と治療手段を提供するとともに、脳科学の主要な問題について解明の糸口を示すことになります。
|
 |
 |
 |
アルツハイマー病の病理学的特徴
|
 |
アルツハイマー病研究の一つの困難な点は、ヒトに特有の病気であり他の動物では引き起こされないことです。これは実験材料が人の脳に限られてしまうことになります。ですからこの研究はアルツハイマー病の病理学的な特徴を調べることから始まりました。
つまり、アルツハイマー病の脳が、健常な人の脳と何が異なっているのかを調べることから始まったのです。外見上の大きな特徴は、脳の萎縮が観られることです。この萎縮は神経細胞が脱落することによって引き起こされています。痴呆の程度と脳の萎縮の程度には相関があり、アルツハイマー病における痴呆は神経の脱落によって引き起こされると考えられています。
2番目の特徴は、老人斑と呼ばれる不溶性の凝集物が沈着していることです。この老人斑は皮膚に観られる、いわば“シミ”のように脳で観察されます。しかし実際には脳の切片を染色することでしかこれを観察することはできません。この老人斑は健常な人でも40歳を過ぎると観察されるようになります。その数は加齢に伴って増加していきます。
アルツハイマー病の脳では老人斑の数は健常の人と比べると非常に多く脳全体に拡がっており、健常の人では観察されない部位にも観察されます。老人斑の構成成分を調べるとベータアミロイド(Aβ)という約39から43個のアミノ酸からなるペプチドでした。このペプチドは膜蛋白であるアミロイド前駆体タンパク質の一部分を構成しており、この蛋白質が分解するときに生じる分解産物だったのです。すなわち、老人斑はこのベータアミロイドが前駆体蛋白質の代謝の過程で細胞内に生じ、それが細胞外に放出され凝集し沈着したものです。
|
 |
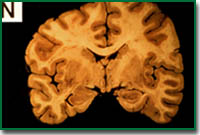
健常な脳 |
 |
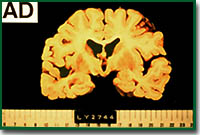
アルツハイマー病の脳 |
3番目の病理的特徴は、神経細胞の中にみられます。アルツハイマー病脳では、神経原線維変化と呼ばれる構造物を持った神経細胞が出現してきます。
この構造物を電子顕微鏡を用いて観察すると、直径10nmの線維が約80nmの周期でよじれあう螺旋構造をしており、paired helical filament(PHF)と呼ばれています。PHFは異常にリン酸化されユビキチン化されたタウ蛋白によって構成されています。タウ蛋白は微小管結合蛋白質であり、細胞の中で細胞骨格を形成している微小管と結合し細胞骨格の安定化に寄与しています。タウ蛋白がリン酸化酵素によってリン酸化されると、タウ蛋白は微小管から離れタウ蛋白同士で結合し神経原線維変化を生じると考えられています(図1)。
この神経原線維変化はアルツハイマー病だけではなく、ピック病や他の痴呆を伴う疾患でも観察されてます。
|
 |
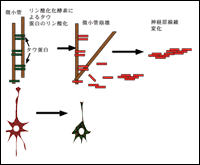
図1 リン酸化酵素によるタウ蛋白のリン酸化
(拡大図38k) |
|
また痴呆の程度と神経原線維変化を持った神経細胞の出現頻度に相関が見られることから、神経原線維変化を生じるメカニズムを知ることが痴呆を解明する手がかりになると考えられます。
|
 |
 アルツハイマー病における神経細胞死機構 アルツハイマー病における神経細胞死機構
|
アルツハイマー病では早期病変として、老人斑の沈着が始まりその数十年後に神経原線維変化、神経細胞の脱落という順序で起こります。これらの病理学的特徴の中に、アルツハイマー病の脳の中で何が起こっているのかを明らかにする鍵が隠されているのです。この病気の説明としてアミロイド仮説があります(図2)。
これは時系列からも明らかなようにベータアミロイドがアルツハイマー病の原因であるとする説です。つまりベータアミロイドが放出され、それが細胞外に沈着する。これが老人斑になります。細胞外にあるアミロイドは神経細胞に作用し、タウ蛋白をリン酸化して神経原線維変化と神経細胞死を引き起こすという考え方です。ここまで来るとアルツハイマー病の研究は人の脳に材料を限定する必要はなくなりました。つまり、アミロイドによる神経細胞死とタウのリン酸化機構を調べればよいことになります。
我々はこれまでに合成したベータアミロイドをラット胎児の海馬初代神経培養細胞に加えることで、アミロイドによって神経細胞死とタウ蛋白のリン酸化が引き起こされることを示すことができました。
そのときに神経細胞内で活性化されている酵素の一つとして、リン酸化酵素(GSK-3β)があることを見つけ出しました。
この酵素はタウ蛋白を過剰にリン酸化する事ができます。
|
さらに、タウ蛋白だけではなくミトコンドリアにあるタンパク質ピルビン酸脱水素酵素をリン酸化し、その活性を抑制してしまいます。この酵素の活性阻害は、代謝産物であるアセチルco Aの産生を低下させ、細胞内でのATP供給の低下を介した細胞死を引き起こします。コリン作動性神経では、アセチルco Aは伝達物質であるアセチルコリンの合成に必要な産物ですから、この活性低下により伝達物質アセチルコリンを合成できなくなります。このことは、刺激に対して充分なアセチルコリンを放出して神経伝達を行うことが十分に行われなくなることを意味します。アセチルコリンを持った神経細胞は脳の各部位に投射しており、記憶や学習にも関係しています。アセチルコリンの低下は、アルツハイマー病で初期に観られる記銘力の低下を説明するかもしれません。
このようにアミロイドによるGSK-3βの活性化によって、アルツハイマー病で引き起こされている現象を説明することが可能になりました。我々は現在、この仮説を動物個体で証明するため遺伝子改変動物を作製して、動物にアルツハイマー病を引き起こすことを試みています。
|
 |
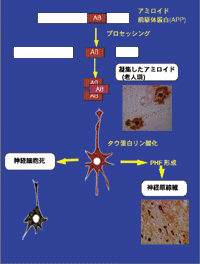
図2 アミロイド仮説
(拡大図62k) |
 |
 |
 |