はじめに
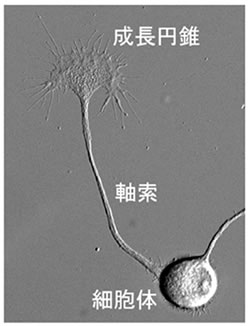
脳神経系の回路網は、どのように形成されるのでしょうか? この仕組みを理解するために、当チームでは神経突起成長の分子機構を研究しています。一般的に神経突起は軸索と樹状突起に分類され、軸索突起は遠隔部位の標的細胞に電気的興奮を伝達する役割を担っています。 神経細胞の細胞体は10~20マイクロメーター程度の大きさですが、場合によっては1メートル以上の軸索突起を伸長します。 このように神経細胞には、自身の大きさの数万倍以上の長さの軸索突起を正確な場所へ到達させる能力が備わっており、この謎を解く鍵は成長円錐と呼ばれる軸索先端部の構造体にあります(図1)。 1890年に脊髄固定標本を観察したRamón y Cajalは、成長円錐を“a concentration of protoplasm of conical form, endowed with amoeboid movements”と記述し1)、その17年後にHarrisonが成長円錐の運動を観察しました2)。現在では、成長円錐の前方移動が軸索突起を引き伸ばすことが知られています3)。さらに成長円錐は、その細胞外環境に存在する分子情報を認識して、軸索突起を正しい道筋に沿って牽引伸長することができます4)。このような神経突起の機能(軸索伸長、軸索ガイダンス)は、成長円錐に発現する多種多様な分子の働きに依存しており、これら分子の機能と役割を解明することにより、神経軸索路発生の仕組みを理解することができます。
細胞接着分子
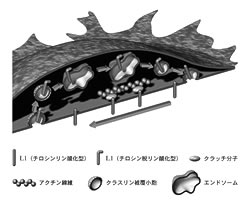
1949年にBickersとAdamsが報告したX連鎖性遺伝性水頭症(XLH)は5)、 脳室拡大と神経軸索路形成不全を主徴とする先天奇形です。 出生直後の外科的短絡術(脳室腹腔シャント術など)により水頭症が良好にコントロールされた症例であっても、その機能予後は極めて不良であり、 神経細胞の発生・分化異常(神経細胞移動障害・神経回路網形成不全など)がXLHの神経機能不全の主原因と考えられています6)。 XLHの60%以上は、細胞接着分子L1の遺伝子変異により引き起こされることが示されており、神経発生過程におけるL1の役割も明らかになってきました。 数年前の当チームの研究により7)、成長円錐形質膜に存在するL1はアクチン細胞骨格による牽引力(後述)を細胞外環境に伝達し、 かつL1が成長円錐細胞表面および細胞内をキャタピラ様に運動することにより軸索突起が伸長することが示されました(図2)。
細胞骨格
成長円錐には主として2種類の細胞骨格系(微小管、アクチン線維)が存在し、微小管は細胞内小胞輸送を担い、 アクチン線維は細胞の形態形成および張力発生に中心的な役割を果たしています。成長円錐のアクチン線維は、空間特異的重合/脱重合およびミオシンモーターの働きにより後方移動しており、 何らかの細胞質分子(クラッチ分子)を介して接着分子の細胞内領域と結合することで、牽引力を細胞外環境へ伝達します。 最近、当チームは神経突起形成過程におけるクラッチ分子を同定し、XLHの原因となるL1細胞内領域遺伝子変異の多くは、クラッチ接続を阻害することで軸索路形成不全を引き起こすことを示唆しました8)。 クラッチ接続/解離の時空間的制御機構は、軸索突起の伸長速度と方向を決定する重要な因子であると考えられます。
細胞膜
成長円錐形質膜に発現する機能分子の多くは、細胞膜小胞として微小管に沿って軸索突起内を運ばれてきます。 また、成長円錐先端縁への細胞接着分子リサイクル(図2)も、形質膜エンドサイトーシスおよび膜小胞輸送を介する分子移動です。 このように軸索突起での細胞膜輸送は、成長円錐局所での形質膜表面積および機能分子発現量を制御する役割を担っています。 最近の研究では、成長円錐内での膜小胞輸送の左右非対称性が、軸索ガイダンスに関与することが示唆されています。
また細胞膜に存在する蛋白質と脂質は、特定の分子同士が集合した微小ドメイン(脂質ラフトなど)を構成することが知られています。 当チームは、細胞局所で脂質ラフトを選択的に不活性化する技法を開発し、成長円錐先端縁近傍の脂質ラフトが軸索突起伸長に必須であることを発見しました9)。 また、脂質ラフトは成長円錐でのL1リサイクルを、空間的に制御することも示唆されています。 現在では、脂質ラフトを場とした細胞内シグナル伝達系の網羅的解析を開始し、脂質ラフトによる軸索突起伸長の分子機構解明を目指した研究を進めています。
細胞内シグナル
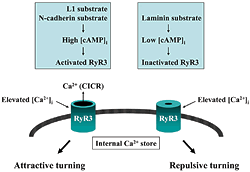
軸索ガイダンス分子の多くは、成長円錐局所(片側)での細胞質Ca2+濃度上昇を介して、軸索突起の伸長方向転換を誘起します。 我々は最近、成長円錐片側性Ca2+シグナルと軸索ガイダンスの関連性を解析し、図3に示す知見を得ました10)。 成長円錐の細胞外環境は、接着分子を介して細胞内cAMP濃度とプロテインキナーゼAの活性を制御し、プロテインキナーゼAにより活性調節された3型リアノジン受容体(細胞内ストアのCa2+チャンネル)が軸索突起の伸長方向を決定します。 このように3型リアノジン受容体は、軸索ガイダンス分子と細胞接着分子による細胞外から細胞内への独立したシグナルを統合し、成長円錐を正しい方向へ誘導しているのです。
おわりに
成長円錐の移動は、1)細胞骨格の分子動態、2)クラッチ接続効率、3)細胞接着分子リサイクル効率、の3主要因子により制御されると考えられます(図2)。 当チームでは、これら3要因が時空間的に制御される仕組みを研究し、軸索突起成長の分子機構の解明を目指しています。また、損傷された成人中枢神経組織での軸索突起先端部の機能を解析し、 軸索突起が損傷組織近傍を伸長できない(再生できない)メカニズムの解明を目標とした研究も行っています。