|
次世代に向かって
いかなる研究手法も完全無欠でないことは自明の理であり、この研究手法も例外ではありません。通常のノックアウトマウスでは、受精卵から成体に至るまで全ての細胞で均質な変異を持っています。このことが場合によっては研究上の制約になることがあります。例えば、ある遺伝子の成体脳での機能に関心を持ってノックアウトマウスを作っても、その変異が原因で発達異常となり、出産を待たずに死亡してしまうことがあります。
その一方で、重要な機能が想定されたにもかかわらず、変異体に表現形がなかなか確認できない場合もあります。この理由には、慢性的に一つの遺伝子の欠失などの異常が存在した場合に、個体の恒常性を保つためにその欠損した機能を代償する反応が成立した可能性があります。機能的に重複する遺伝子が多数ある場合には、よりその可能性が高まります。これらに加え、とりわけ複雑な神経回路網によって機能を獲得している脳組織の場合、異常行動としての出力の責任領域および機構を特定することは必ずしも容易ではありません。それには何らかの工夫が必要となります。
私たちのチームは、外的刺激に関連して長期的な変化(学習・記憶)が脳の中で成立する分子機構の遺伝学的解析を目標として取り組んでいます。また、その過程でマウス個体を用いた遺伝学的手法の開発・改良を試みています。
現在の方法論的努力は、主に組織あるいは細胞種特異的変異導入法および時期特異的変異導入法の開発に向けられています。これは Cre と呼ばれる組み換え酵素を組織あるいは細胞種特異的に発現させることにより、その酵素依存的に特定の遺伝子に変異を導入しようとする技術です。このためには、Cre のトランスジェニック(Tg)マウスを作製することが必要ですが、研究目的によって Cre を発現させたい細胞および時期は異なります。
しかし、研究目的に合致した発現特性を持つ Cre-Tg マウスを計画的に作製するために利用できるプロモーター(遺伝子の発現を起こさせる DNA 領域)の種類が充分に揃っていないため、プロモーター探しには労力と時間を必要とします。図4に大脳皮質特異的に Cre を発現させた結果を示します。Cre が発現し、標的遺伝子座に変異が導入さたことを青色が表現しています。白色の領域は標的遺伝子座が完全であり、正常に機能する部分です。
さらに、変異を導入する時期を任意に操作できるとすると、同一個体から変異導入前と後の2点の情報を入手することができます。この技術により、個体間差の因子を排除することができるので、特に動物の行動(例えば学習・記憶)と特定遺伝子の関連をより正確に評価しうるものとして期待されています。
現在までにいくつかの方法論が提案されていますが、私たちはステロイドレセプターとそのリガンドを利用し、蛋白質として翻訳された後に Cre の活性を制御するシステムの活用を試みています。この手法では、Cre 酵素とステロイドレセプターのリガンド結合ドメインを予め融合させたキメラ蛋白質を発現するようにした Tg マウスを作製します。この Tg マウスではプロモーターの特性により、キメラ蛋白質が発現される細胞は規定されますが、発現しただけでは Cre の組み換え酵素活性を発揮することができません。しかし、リガンドを体外から投与することにより、キメラ蛋白質は活性化され組み換え酵素活性を獲得します。これにより標的遺伝子に変異を導入することが期待されます。
|
- |
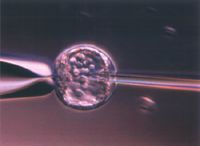
画像をクリックすると拡大します。
図2 ES細胞マウス初期胚への顕微注入
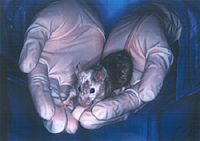
画像をクリックすると拡大します。
図3 C57BL/6マウス由来のES細胞から生まれたキメラマウス(黒い部分はES細胞由来、白色部分は注入されたBALB/C系統の胚由来)
|
 |