私たちは一人ひとり、異なった身体の特徴を持っていますが、こうした個人差は、遺伝子、環境、そしてこれらの相互作用から生まれます。個人差を生み出す遺伝子の個人差は、主として両親から半分ずつ受け継ぐひとそろいの染色体DNA、すなわち「ゲノム」にコードされています。しかし、実は私たちはもう一つの「ゲノム」を持っています。ミトコンドリアDNA(mtDNA)です。
ミトコンドリアは、細胞の中に網の目のように張り巡らされた構造(細胞内小器官)で、エネルギー物質をつくり出すことや細胞内カルシウム濃度の調節など、さまざまな働きを持っています。細胞の中と外には、約1万倍のカルシウム濃度の差があり、カルシウム濃度の調節は、細胞の生死、信号伝達、物質の分泌、シナプスの働きの変化など、多くの生理的な働きに関係しています。
細胞内小器官であるミトコンドリアが独立した遺伝子を持っているのは、おそらく太古の昔に細胞に寄生するようになった細菌の名残だからではないかと考えられています。
mtDNAは、染色体DNAより進化の中で変化する速度が速いため大きな個人差が見られ、親子鑑定や犯罪捜査などで個人を特定するために使われています。そして、ヒトの病気との関係も疑われており、例えば糖尿病の1パーセント弱がmtDNA異常によるものと考えられています。mtDNAの個人差がさまざまな病気(糖尿病、心臓病、アルツハイマー病など)へのかかりやすさと関係する可能性が、膨大な研究から指摘されていますが、これらの研究はすべて「病気を持っている人と持っていない人とで、あるmtDNA配列の頻度を比べる」という研究方法(遺伝子関連研究)によって行われてきました。しかし、こうしたmtDNA配列が細胞の働きに影響するのかどうかは、技術的な困難さから、ほとんど分かっていませんでした。
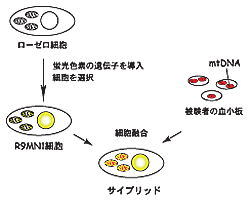
そこで私たちは、35人の方々の協力を得て採血し、血液から血小板(染色体DNAは含まないが、mtDNAを含む)を取り出し、mtDNAを持たない細胞(ローゼロ細胞)と融合させる方法を用いました。このローゼロ細胞にはあらかじめ、ミトコンドリアの機能(カルシウム濃度やpH)にしたがって蛍光の色が変わる蛋白質の遺伝子を組み込んでおきました。こうして作製した35の細胞株で、この蛍光蛋白質の蛍光を測定するとともに、これらの全細胞株で、約一万六千塩基対におよぶmtDNAの配列を解読しました。
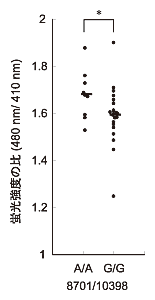
その結果、8,701番目と10,398番目の2つの塩基が、いずれもA(アデニン)からG(グアニン)に変わると、ミトコンドリア内のカルシウム濃度が低くなり、pH(水素イオン濃度)がアルカリ性に傾くことが分かりました。
このうち、10398G型は長寿との関連が指摘されており、10398A型はアルツハイマー病、パーキンソン病、躁うつ病などの危険を高める因子であると報告されていました。また、10398A型と密接に関連した5178C型は糖尿病、動脈硬化、心筋梗塞など、さまざまな生活習慣病との関連が指摘されています。
これらのことから、10398A型の配列を持っていると、ミトコンドリアの機能が変化してさまざまな病気になりやすく、一方で10398G型を持っていると、これらの病気にかかりにくいため、長寿になる可能性が考えられます。
もし本当にmtDNAの1、2ヵ所が変化するだけで、長寿になったり、生活習慣病にかかりやすくなるとすれば、ミトコンドリアの働きを変える薬が健康長寿のための薬になる可能性もあり、今後の研究の進歩が期待されます。