機能的脳イメージングの発達は脳機能の解明において著しい進歩をもたらしています。fMRIのような画像技術と認知科学の従来の方法の組み合わせによって、特定の行動反応と対応する脳領域における活動パラメータの間の顕著な相関関係が明らかにされてきています。脳研究をさらに発展させるには、これらの領域の細胞間ネットワークのレベルで何が起こっているのかを解明することが重要となります。残念なことにこのようなレベルでの問題に対処できる実験技術はまだ限られています。計算神経科学の利用により一定の進歩が可能となってきています。しかしながらこのアプローチは脳細胞コミュニケーションの仕組みおよびその結合の解剖学的構造についての知見に依るところが大きいのです。
最近まではシナプスによって相互結合している神経のネットワークが脳の主要な機能構造であると考えられていました。これには歴史的な理由があります。100年以上前のことですが、Ramón y Cajalがニューロンの主要タイプと脳内におけるその結合について報告しています。これが光学的方法によって細胞神経科学においてなされた最初の顕著な進展でした。それ以降は電極を用いた手法がこの分野では多用されるようになってきています。これらの手法によってニューロンは活動電位およびシナプス後電位のような電気活動を生成することが明らかにされています。電気シナプスおよび化学シナプスが報告されています。脳を電気装置として、ニューロンはシナプス入力を統合する脳の基本単位として見られるようになったのです。1970年代初頭においてシナプス可塑性(長期増強作用と長期抑制作用)が報告された際に、その可塑性が学習と記憶のメカニズムであることが提案されました。それ以来、多くの研究室がシナプス可塑性と記憶との関連性を見出そうと実験を重ねてきました。
脳細胞相互のシナプス領域外相互作用という考え方は、脳の働きについての見方における重要な変化から生まれました。30年程前に「ボリューム伝達」という概念が考え出されました。この概念では細胞外間隙においてニューロン受容体のための一定量の作動物質が常に存在するという提案がなされています。この作動物質はシナプス領域外受容体に作用し、ニューロンの大きなグループの活性を調節します。これは当時としては先駆的な考え方でしたが、残念なことに「シナプス領域外は調節性を意味する」と限定されていました。現在でも極めて少数の神経科学者は、依然としてシナプス領域外の伝達物質の作用はシナプスのネットワークの調節のみであると考えています。1990年代中頃にDimitri Kullmannは神経伝達物質スピルオーバーがシナプス間の漏出の仕組みであると提案しました。彼はシナプスが関与する事象の際に放出されるグルタミン酸はシナプス間隙から逃れて(スピルオーバー)、隣接するシナプスのNMDA受容体に到達すると主張したのです。この考えは当初はシナプス領域外伝達物質の拡散をシグナル伝達と関連付けるものであり、それが一過性の性質であることが提案されました。
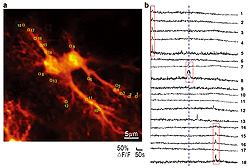
蛍光カルシウムイメージングによる2つの海馬アストロサイトの蛍光画像(a)およびCa2+過渡増加の記録(b)(BSI平瀬研究ユニットとの共同研究)。黄色の囲みが観測領域(ROI)(a)。200μMのグルタミン酸への浸漬前後(青色の点線、b)のROI1-18から記録したCa2+過渡増加。赤い囲みが示すアストロサイトの単一コンパートメントに限局されたCa2+過渡増加(突起または細胞体)。
Figure by Mrs Pei‐Yu Shih
もうひとつの重要な発見はグリア細胞の一種であるアストロサイトがニューロン受容体の作動物質を放出しているということでした。残念なことに最初の形態学的研究以降はこれらの細胞は忘れさられていました。「グリア(glia)」という名称は糊(glue)を意味していました。すべての非神経細胞は神経間の空隙を満たす糊と見なされており、電気的にそれらを絶縁しているというのです。電極を用いた方法の時代では、アストロサイトは電気的には不活性の細胞であり、何ら情報を伝達することはないと考えることは理にかなったことでした。ニューロン‐アストロサイト相互作用はアストロサイトによるニューロンの栄養補給に限定されていました。しかしながら最新の光学的方法がアストロサイトについての私たちの見方を根底から変化させたのです。レーザー走査顕微鏡法を含む蛍光カルシウムイメージングを用いて、アストロサイト内に出現するカルシウムの増加とそのプロセスを見ることが可能となったのです(図1)。この知見はアストロサイトは電気的には不活性ですが、様々な種類の活性を生み出すことが可能であることを示唆しています。これらのカルシウムの過渡電流の意味はまだ十分には解明されていません。一部の科学者はそれらを伝達物質の細胞外放出と関連付けていますし、別の科学者はそれに反論しています。この好奇心をそそる問題についての研究は私たちのラボの研究方向のひとつとなっています。
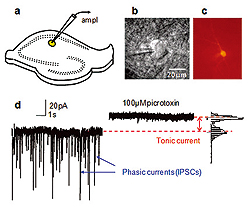
a. CA1 str.radiatum介在ニューロン(黄色)上のパッチクランプ電極を設置した海馬切片を示した図。
b. パッチピペットの先端と介在ニューロンの赤外線DIC画像。
c. 細胞の詳細な形態学的情報を得るための実験後のビオシチンAlexa Fluor594で満たして可視化した介在ニューロン。
d. NMDAとAMPA受容体拮抗物質の存在下での電位固定法による記録。
100μMのピクロトキシンによって阻害される突発性シナプス前GABA放出と突発性シナプス前活動電位に由来する突発性IPSC。さらにピクロトキシンによってシナプス領域外GABAA受容体に介在される緊張性電流を遮断することによって電流を抑制する上での変化がもたらされている。
Figure by Dr. Inseon Song
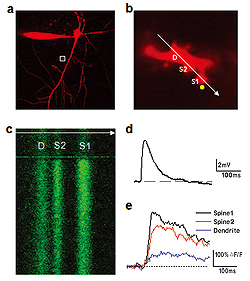
a. カルシウムの指標であるFluo-5F(300μM)と形態学的トレーサーであるAlexa Fluor594(50μM)で満たされたニューロン。ニューロンの形態を示すAlexa Fluor 594のチャネルのみが提示されている。
b. 尖端樹状突起の枝の拡大画像(aの枠内)。同時に回線走査(白い矢印)の位置と二光子アンケージングの点(黄色い円)を示す。Dは樹状突起、S1とS2はスパイン。二重走査イメージングシステムOlympus FV1000を用いてイメージングとアンケージングを同時実施。
c. 2つのスパインと親樹状突起を横断的にみたFluo-5F蛍光の回線走査画像。蛍光の増強はNMIグルタミン酸のアンケージングによって誘発される。
グルタミン酸アンケージングによるニューロンの神経体細胞において誘発される脱分極電位(d)と樹状突起と2つのスパインにおける対応するカルシウムの増加(e)。
Figure by Mr Yu‐Wei Wu
調節性のボリューム送信という当初の概念とは対照的に、最近の知見では細胞外伝達物質の作用は迅速かつ一過性である可能性が示唆されています。例えばグルタミン酸がシナプス間隙から漏出またはアストロサイトから放出された際には、狭い細胞外間隙内で比較的高濃度となります。その後に放出場所から拡散していき、トランスポーターによってニューロンおよびアストロサイトに戻されます。その結果、放出地点に近位の高親和性受容体のみが活性化されることになります。原理上はこれらの受容体はシナプス性およびシナプス領域外性の双方になる可能性があります。しかしながらシナプスは多くの場合、高密度のトランスポーターを含むアストロサイトのプロセスによって孤立しています。この保護的キャップはシナプス領域外の作動物質のシナプス受容体へのアクセスを制限しています。自由にアクセスが可能なシナプス領域外受容体はシナプス領域外の伝達物質にとっては容易な標的となります。
非シナプス受容体の活性化の条件解明は私たちのラボのもうひとつの研究方向です。現在のところ私たちはシナプス領域外のイオンチャネル型のGABAAとNMDA受容体の研究を行っています。これらの受容体はそれぞれ主要抑制性神経伝達物質であるGABAおよび主要興奮性神経伝達物質であるグルタミン酸によって活性化されます。
シナプス領域外GABAA受容体は周囲のGABA濃度を検出することが可能です。その仲間のシナプス受容体と比較して、これらの受容体はGABAに対して高親和性と緩慢な脱感作速度を有しています。これによって持続的な緊張性電流を調節することが可能となります(図2)。このような緊張性電流は多くの脳領域のニューロンで見出されてきています。シナプス領域外GABAA受容体の存在および密度、GABA放出源の近接性、そして細胞近傍のGABAトランスポーターの密度によって緊張性電流の大きさが決まります。その結果一部のニューロンは他のニューロンよりもより緊張性電流を発現することになります。そのような細胞型特異性はネットワークにおける重要な意義を持っています。周囲のGABAが一定の種類の反応の際に増加した場合には、他のニューロンよりも局所的ネットワーク内の特定のニューロンにおいてより大きな緊張性電流を生み出します。
ニューロンのシナプス領域外NMDA受容体は生理条件下では持続性電流を調節することはありません。グルタミン酸はシナプス領域外空隙に存在する可能性がありますが、これらの受容体チャネルはMg2+イオンによって遮断されます。この電位依存性の遮断は受容体の活性化を抑制します。これはEPSPや活動電位のようなニューロンの脱分極によって除去されます。NMDA受容体は高カルシウム透過性を有していることから、私たちは海馬ニューロンのスパインと樹状突起においてそれらの活性化を調べるために二光子蛍光カルシウムイメージング法を用いています(図3)。
もうひとつの謎はアストロサイトで見出されるNMDA受容体に関連しています。これらの受容体もグルタミン酸濃度を検出することができますが、アストロサイトは活動電位の発火またはEPSPの生成を行って、Mg2+の放出による遮断をもたらすことはありません。つまりこれらの受容体はMg2+によって遮断されることはなく、グルタミン酸にされされる毎に電流を生成することが可能です。電気的に不活性な細胞におけるこのような電流の機能は何でしょうか?私たちにはいくつか思いついた点があります。それを知りたければ、私たちのラボを訪問してください。






