樹状突起フィロポディアは、脳の神経回路形成初期の未成熟なニューロンに豊富に見られる構造で、バラの棘のように細長く、運動性に富み、他のニューロンの軸索と未熟なシナプス結合を形成します。フィロポディアはその後、スパインといわれるキノコ型の形態へと成熟し、軸索とのシナプス結合は安定なものへと変化します。スパインは、哺乳類の脳の興奮性シナプス中90%以上のシナプス後部構造を構成しています。このように樹状突起フィロポディアはスパインの前駆体として重要な構造ですが、樹状突起フィロポディアの形成・維持およびフィロポディアからスパインへの移行の分子機構は、ほとんど何も分かっていませんでした。
テレンセファリン(TLCN、ICAM-5)は免疫グロブリンスーパーファミリー、特にICAMファミリーに属する細胞接着分子です。TLCNは、終脳と呼ばれる脳の最も吻側の領域に存在するスパインを持ったニューロンにのみ限局して発現しています。終脳は学習、記憶、情緒、意識、感覚情報の統合、運動の制御などの高次脳機能を担当している脳領域です。TLCNは終脳のニューロン中で樹状突起のみに局在し、軸索には存在していません。TLCNの発現開始時期は、出生後の樹状突起伸長・スパイン成熟・シナプス形成のタイミングに一致しており、その発現は成体まで持続します。
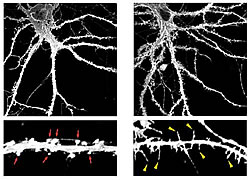
当チームは本研究において、TLCNがスパイン成熟の負の制御因子であることを発見しました。まずTLCNの局在部位を明らかにする目的で、マウス海馬から培養したニューロンを用いて、抗TLCN抗体とさまざまな細胞内部位を特異的にラベルする各種抗体による多重免疫染色を行いました。その結果TLCN は、(A)樹状突起に選択的に局在し、軸索には存在しないこと、(B)特にシナプス形成早期の樹状突起フィロポディアに豊富に存在すること(図1)、さらに(C)シナプス形成後期に多く見られる成熟したスパインでは発現量が大きく減少していること、を見出しました。これらの結果より、TLCNは樹状突起フィロポディアの形成・維持およびシナプス成熟に関与している可能性が示唆されました。
次にTLCNの樹状突起フィロポディアにおける機能を明らかにするために、TLCN過剰発現ニューロンおよび遺伝子欠損マウスの樹状突起形態の解析を行いました。TLCNをニューロンに過剰に発現させると、フィロポディアの数が多くなり、スパイン数が減少しました(図2)。逆に発達期のTLCN遺伝子欠損マウスでは、フィロポディア数が減少し、スパイン成熟が早くから観察されました。以上の結果より、TLCNはフィロポディアからスパインへの成熟を抑制する機能を持つことが示されました。また、成体のTLCN遺伝子欠損マウスのニューロンでは、正常マウスのスパインよりも大きなスパインが多数観察されました。この結果はTLCNが欠損すると、より堅く、融通性の低いシナプスとなってしまうことを意味し、成体脳においてもTLCNが脳に柔らかさを与えるという重要な役割を果たしていることを示唆しています。
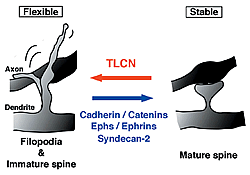
これまでにカドヘリン、Eph/ephrinなどの多くの細胞認識・接着分子群がスパインの成熟・安定化を引き起こすことが報告されていますが、 TLCNはこれらとは逆の方向に働く、すなわち未熟な運動性の高いシナプス結合を維持する新規の細胞認識・接着分子であることが分かりました(図3)。私たちは、このような双方向のシナプス形態調節メカニズムがうまくバランスをとることにより、発達期における神経回路形成および成体期におけるさまざまな高次脳機能発現のための神経回路再編成が調節されていると考えています。