アルツハイマー病(AD)は、加齢により発症リスクが高まる進行性の認知症であり、高齢化社会における最も重要な問題の一つです。しかしながら、我が国でAD治療薬として認められているのは、アセチルコリン(AD脳で低下している神経伝達物質の一つ)分解酵素の阻害剤であるアリセプト(塩酸ドネペジル)のみであり、その効果は短く、しかも対症療法にとどまっているのが現状です。これまでの研究結果から、ADはアミロイドβ ペプチド(Aβ )という物質の過剰な蓄積が発症の引き金になると考えられています。この蓄積したAβ を、もしくはAβ が蓄積する前に分解・排除することができれば、ADは治療・予防できるのではないだろうか?という着想で、私たちは研究を進めてきました。その結果、脳内でAβ を分解する酵素として「ネプリライシン」を同定するに至りました。ネプリライシンは、加齢に伴ってその発現が低下することや、実際にADの発症前段階で低下することが次第に明らかとなり、ネプリライシン活性が低下することで、脳内Aβ が蓄積することが証明されました。一方で、ネプリライシンの発現・活性を高める実験的遺伝子療法をマウスで試みたところ、脳内Aβ 量が減少することも確認されました。すなわち、ネプリライシン活性を選択的に高めることができる物質(薬剤)が、ADに対するたな予防・治療法(薬)になると考えられるのです。
今回の成果
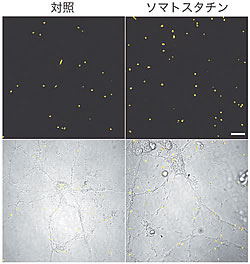
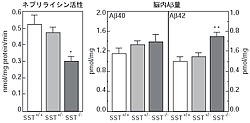
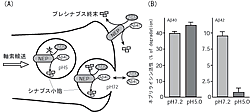
そこでまず、ネプリライシン活性を評価するための測定法を構築し、ネプリライシン活性を増強するような因子のスクリーニングを行いました。その結果、神経ペプチドの一つであるソマトスタチン(SST)が、ネプリライシン活性を高めることを見出しました(図1)。SSTは、アセチルコリンと同様に、AD脳でその量が低下していることが知られていましたが、その因果関係は不明のままでした。上述のin vitroの結果より、SSTがネプリライシン活性を制御する可能性が示されたので、ソマトスタチン欠損(SST-KO)マウスを用いて、in vivoでのSSTの効果について検証を進めました。SST-KOマウスでは、Aβ の代謝に関与しているネプリライシン以外の因子の発現や活性には差が認められませんでした。しかしながら、SST-KOマウスの海馬でのネプリライシン活性は、野生型と比較して約60%にまで低下しており、それに逆相関して脳内Aβ 量の増加が認められました。特に、Aβ 42(Aβ 40よりもはるかに神経毒性が高い)が選択的に有意に増加していることが明らかとなりました(図2)。さらに解析を進めた結果、SST-KOマウスの脳ではネプリライシンの発現が低下しているだけではなく、その局在にも異常が認められました。ネプリライシンは、プレシナプスに局在することが知られていましたが、SST-KOマウスではプレシナプスへの局在が低下していたのです。この局在の異常には大変重要な意味があります。ネプリライシンは、プレシナプスへ局在しなければAβ 42を分解することができないからです(Aβ 40は輸送小胞内でもプレシナプスでも分解される)(図3)。以上の結果から、SSTはネプリライシンの発現および局在を制御することで、Aβ 42の分解に対して選択的に作用していることが明らかとなりました。
SSTには5種類のソマトスタチン受容体(SSTR)が確認されています。どのSSTRがネプリライシン活性を制御しているのかが明らかになれば、それを標的とした薬剤によって、より副作用も少なく、かつ効率的に脳内Aβ レベルを低下させることが可能になると考えられます。また、加齢やADによってSSTレベルの低下が認められることから、補充療法的な意味合いも得られます。さらに、ネプリライシン活性が約2倍増加するだけで脳内Aβ 量を低下させることが知られているので、長期的視点に立てば、ネプリライシン活性をわずかに増強するだけでも脳内Aβ レベルを低下させるのに有効であるとも考えられるため、SSTRを標的とした薬剤は予防薬としても非常に有用であると推察されます。今回明らかになった成果は、ADの治療・予防法の開発において、新たな治療標的を示しただけにとどまらず、孤発性AD(AD患者の大部分を占める)の発症機構の解明にも大きく貢献する可能性が高いため、今後のさらなる展開が期待されています。