脳はどうやってできるのか?そのマスター・プランとは?誰もが興味を抱きそうな話です。生命の設計図は遺伝暗号からなるゲノムにあります。1990年代後半から神経系を有する生物のゲノム配列は次々と明らかにされ、2004年10月にはヒトのゲノム配列決定もほぼ完了し、約2万2千個の蛋白質をコードする遺伝子の存在が推定されました。勿論、脳の基本的な設計図もゲノムに刻まれています。胎児期と生後初期の発達は、この遺伝的な設計図に基づいてよくコントロールされています。特定の遺伝暗号が特定のステージに特定の部位(あるいは細胞)で読まれる、すなわち特定の脳形成遺伝子が特定の時空間で発現することで、脳の基本的な構造(細胞の分化と形態形成、基本的回路の形成、脳の領域化など)は順次構築されていきます。また、学習し記憶する器官である脳は、その発達においても可塑性に富み、生後の体験などに応じた順応性のある設計図であると考えられ、神経活動依存的に細微な発達が進み(シナプス結合とその選別・強化など)、記憶・学習、意識、心などといった高次機能を発揮する高度に複雑な器官へと成長を遂げます。
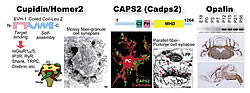
upidin/Homer2、CAPS2、Opalin。Cupidinは後シナプスの分子構成とスパイン形態の調節に関与する。CAPS2は神経栄養因子分泌の調節でニューロンの分化・生存に関与する。最近同定したOpalinは中枢ミエリンのパラノード・ループに特異的な膜蛋白質で、プルキンエ細胞軸索の髄鞘化時に発現する。
ポスト・シーケンス時代の到来で、脳の遺伝的な設計図(遺伝的青写真)の謎解きが、俄然、現実味を帯びてきました。私たちのチームの第一プロジェクトは、マウス小脳の生後発達をモデルにして、その遺伝的な青写真の解読を目指すことです。ディファレンシャル・ディスプレイやマイクロアレイ法などによるゲノムワイドなスクリーニングで時間的(ステージ特異的)遺伝子発現パターンを、in situハイブリダイゼーション脳組織化学法によって空間的(細胞特異的)遺伝子発現パターンを大規模に解析し、得られる大量の情報を統合データベースに体系化します(図1)。今春には、オンラインの「小脳発達トランスクリプトーム・データベース(CDT-DB)」として一般に公開予定です。今後は、 CDT-DBをより強化するとともに、脳発達イベントごとの遺伝子ネットワークを解明したいと考えています。また、環境に順応性の高い脳の遺伝的設計図の仕組みを探るために、生後の体験や後成的な要因と遺伝子発現の関係についても解析していきたいと考えています。
第二のプロジェクトは、脳発達の分子・細胞メカニズムの研究です。CDT-DBプロジェクトを通して、新規の脳発達関連遺伝子候補が数多く見つかってきました。これらの遺伝子研究を皮切りに、脳発達の理解を深めることを目指します。当研究チームにおいては一人の研究員が複数個の新規候補クローンを担当して研究を進めており、これまでに、Cupidin/Homer2(後シナプス足場蛋白質)(Shiraishi et al., 1999, 2003, 2004)、CAPS2(Ca2+依存性の神経栄養因子分泌調節蛋白質)(Sadakata et al., 2004)、Opalin(オリゴデンドロサイト特異的なパラノード・ループ蛋白質)(Yoshikawa et al.,未発表)などが同定されました(図2)。今回は、CAPS2がニューロンの分化と生存にかかわる事が分かってきた、最新の研究成果について紹介します。
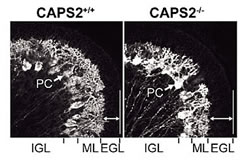
CAPS2は、当研究チームの定方哲史研究員によって、生後7日齢のマウス小脳の顆粒細胞で、mRNA発現がピークになる遺伝子として発見されました。名称は、CAPS(Ca2+ dependent activator protein for secretion)に高い相同性を示すことから由来します。CAPSは有芯小胞(カテコールアミンやペプチドホルモンなどを含む)のCa2+依存的な開口放出に関わることが知られています。ところで、小脳顆粒細胞では神経栄養因子のBDNF(brain-derived neurotrophic factor)とNT-3(neurotrophin-3)が発現しており、いずれも小脳発達には必須です。定方研究員は、CAPS2がプルキンエ細胞とシナプス結合する平行線維終末において、BDNFやNT-3を含有する小胞に会合して存在することを突き止めました。また、培養細胞PC12および小脳初代培養細胞を用いて、CAPS2がBDNFとNT-3の活動依存的な分泌を制御していることを明らかにしました。小脳培養系で顆粒細胞にCAPS2を大量発現すると、プルキンエ細胞の生存率が約2倍上昇することも分かりました。以上のことから、CAPS2は神経栄養因子の活動依存的な分泌を制御して、小脳ニューロンの分化・生存にかかわることが示されました(Sadakata et al., 2004)。BDNFとCAPS2の発現パターンが、海馬や大脳皮質においても一致することから、これらの領域におけるCAPS2を介したBDNF分泌調節の研究も進めています。さらに最近、CAPS2遺伝子のノックアウトマウスの作製に成功し、以下の興味深い結果が得られています。(1)小脳葉形成異常 ―第VI葉―第VII葉間の溝の消失、(2)第VI・VII葉の外顆粒層における顆粒細胞アポトーシスの亢進、(3)プルキンエ細胞樹状突起の未成熟(図3)、(4)小脳顆粒細胞移動の遅滞、(5)大脳皮質・海馬におけるParvalbumin陽性細胞数の減少、(6)大脳皮質初代培養におけるBDNF分泌量の低下、(7)体重の減少、(8)小脳性協調運動能の低下、(9)モリス水迷路における学習・記憶障害、(10)サーカディアンリズムの異常、(11)ホモ母親の育仔放棄。このうち、(1)、(3)、(4)、(5)、(6)、(9)の症状はBDNFノックアウトマウスでも見られる所見で、 CAPS2によるBDNF分泌の重要性が示唆されます。
これまでBDNFやNT-3に関しては、その受容体Trkに結合した後のシグナル伝達カスケードの研究や、それらの遺伝子発現制御などに関する研究が世界中で行われ、多くの重要な知見が得られています。しかし、その分泌を直接制御する分子メカニズムの研究はほとんどありませんでした。定方研究員が初めて明らかにしたCAPS2依存性の分泌は、この分子メカニズム解明への糸口になると期待されています。今後、ノックアウトマウスなどの解析から、CAPS2 依存性のBDNF/NT-3分泌の生体内における役割がさらに明らかになるでしょう。
おわりに
私たちのチームでは、脳の発達をもたらす遺伝子体系とそれによってコントロールされる分子・細胞メカニズムの解明を目指します。この目的の達成ため、みなさんとの学際的で実りの多い共同研究を今後ともよろしくお願いします。