若い脳では経験に応じて神経回路の組み換えや再構成を行う能力(「可塑性」という)が高く、知識の向上など大人になっても学習力を維持できる一方、一般的な脳機能は発達初期の限られた時期に形成されます。今回、研究チームでは、少数で多種にわたる抑制性細胞群の発達と臨界期における可塑性の発現との関係に着目しました。まず、抑制伝達の制御を抑える遺伝子を導入したノックインマウスを用いて、20種類以上も知られる抑制性の信号を受け取る受容体の中で、どの神経細胞の結合が臨界期における単眼遮蔽の感受性(視覚刺激を受け取ることによって生じる神経細胞の組み換え)を支配しているかを詳細に検証しました。また、最終的には形態的に神経回路網(つまり脳)がつくられて臨界期が終了されると考えられるため、抑制性伝達が脳の構造形成に及ぼす影響を詳しく調べました。具体的には、正常な視覚環境で育ったネコのコラム構造を、発達中に抑制性伝達を薬理学的に操作し、人工的に形づけることを試みました。
研究手法と成果
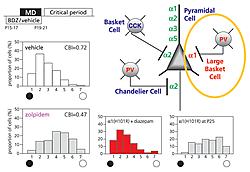
ベンゾジアゼピン薬は、神経細胞内のある限られたGABAA受容体の特定なアミノ酸に結合し抑制性伝達を制御します。遺伝子操作によりこの薬理学的感受性を一つ一つ取り除いたマウスを用いて、視覚刺激による可塑性の出現を調べました。
正常なマウスでは、視覚領の神経細胞は左の目からの光刺激に良く応答するものと、右の目からの光刺激に良く応答するものとが一定の割合で存在しています。また、臨界期にないマウスでは、片目を覆って飼育する前と後でも、電気生理学的に測定したこの割合は変化しません。しかし、臨界期中のマウスの片目を遮蔽すると、開いた目からの視覚刺激により神経回路が発達して、光刺激に良く応答する神経細胞の割合が増加します。したがって、臨界期前の若いノックインマウスにベンゾジアゼピン薬の投与とともに片目を遮断した結果、覆わなかった目からの光刺激に良く応答する神経細胞の割合が増加すれば、早まって臨界期が出現したと考えられます。
実験の結果、神経伝達の受け手であるGABAA受容体のうち、α1サブユニットの機能を取り除いたノックインマウス以外では、開眼直後で臨界期における可塑性が薬理学的に誘導され、通常のマウスに比べて10日早まって出現しました。すなわち、抑制性の情報伝達によって神経の可塑性を司る特定の受容体(α1)を初めて詳細に同定することに成功しました(図1)。
2)形態的解析
臨界期にあらゆる脳機能の神経回路網が集中的に形成される仕組みとして、一時的に高まる機能的可塑性と形態的可塑性に大別されます。前述のように、個々の細胞の電気的活動を記録すると機能的変化(視覚情報に細胞がどのように反応しているか)を知ることができます。
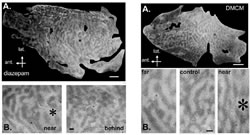
一方、片方の眼球に色素(白色)を導入すると、形態的に入力が変化すること(視覚情報によって脳の形がどのように変わるか)を可視化することができます。例えば、ネコやヒトのように前向きの眼から第一次視覚野への入力はほぼ一対一の割合で白、黒、白、黒と、片方の眼からの入力に強く反応する細胞の集まり(これを眼優位性コラムと呼びます)が観察されます。正常な光環境で育った発達中の子ネコに、異なった作用を持つベンゾジアゼピンを大脳皮質に直接投与し、それぞれの薬を投与したネコで出現する眼優位性コラムの間隔の違いを、正常なネコと統計的に比較しました(図2)。
その結果、抑制性伝達を抑えるDMCMを投与したネコでは、正常ネコと比較して眼優位性コラムの構造が縮小するのに対し、抑制性伝達を強化するジアゼパムを投与したマウスでは正常のマウスと比較して3割、眼優位性コラムの間隔の拡張が見出されました。すなわち、大脳神経細胞の構成を人工的に制御することに世界で初めて成功しました。
研究の意義
- 大脳における可塑性(学習)の構成原理が大きく解明され、現実的で詳細な局所神経回路網の数理モデルの形成と解析を可能としました。また、脳の他領域の臨界期を探るための候補となる細胞標的が具体化しました(図1)。
- 脳内神経回路の抑制性が充分に発達していない、生まれて間もない時期に、一定のレベルの抑制性の刺激を薬剤(ジアゼパム)で与えると可塑性が一種の特有な結合を介して早まって発現しました。これらは精神安定剤を幼児に採用する際に、抗発作効果と臨界期の出現への副作用を識別する、新しい薬剤開発の手掛りとなります。
- 生涯のうち1回しか出現しない臨界期中に脳内抑制を操作することにより、大脳の基本構造となるコラム間隔を人工的に調節できました。個人差を示すこの脳の形態が、遺伝子によってあらかじめ決められているものではなく、神経活動(経験)依存的に形成されることが強く支持されました。
- ネコやマウスのように異なった行動、視力や発達を示す動物種において、発達初期における脳内抑制の一般的な役割が確認されました。今回の動物実験の成果はヒトの育成や治療への応用を示唆するものです。 これらの結果より、特有な抑制性伝達を操作することにより臨界期の出現時期や大脳の構造まで変化させることができる、ということが初めて示されました。この発見は脳の構成原理の解明に新たな知見を与えるとともに、脳の個人差や正常な脳の発達の理解、再生・移植した脳組織を正常に機能させる手法の確立に貢献することが期待されます。