生体分子は、生きた細胞の中で常に動いています。動力の種類によって、“拡散”あるいは“輸送”と呼ばれ、動きのレンジ(幅)によって、“揺らぎ”(幅が小さい場合)あるいは“移行”(幅が広い場合)と呼ばれます。そうした生体分子の動きの時間的・空間的制御が、細胞の増殖、分化にとって重要であることが分かってきました。Green Fluorescent Protein (GFP)など、オワンクラゲやサンゴ・イソギンチャクに由来する蛍光蛋白質を使って、生体分子をラベルして可視化する技術(蛍光イメージング技術)は広く普及しています。しかし一般的には、ラベルした生体分子の分布の定常状態を観察することしかできません。動きに関する定量的な情報は得られないのです。
生体分子の動きを追跡するために、従来、蛍光の褪色を用いる技術が使われていましたが、褪色を起こすのに時間がかかるため、遅い動きしか観察できませんでした。光を当てることで生体分子の蛍光を瞬時にスイッチオンするような技術(光で任意に分子をラベルする技術)は、2002年に始まりました。例えば我々は、紫(外)光で緑から赤に色を変えるKaedeを発表しました。しかし、Kaedeの光ラベルは不可逆的で、赤になったKaedeを緑に戻すことはできません。一つの細胞につき一回のラベルしか施行できないのです。生体分子の動きを、ある時間一点でしか追跡できないことになります。しかし生体分子の動きは、刺激の前後などで変化することが予想されます。同一の細胞で何回も繰り返して生体分子の動きを観測するためには、定期的にリセットをかけて(以前にラベルした蛍光を消去して)新たに光ラベルし、動きを観測できるような技術が必要となります。
我々は、ウミバラ科の石サンゴから、新規の緑色蛍光蛋白質をクローニングしました。これに遺伝子変異を加えることによって、単量体でフォトクロミックな性質(物質が光を吸収することによって、色が可逆的に変化する性質)を示す変異体を開発することができました。普段は、青色領域に吸収を持っており、青色のかなり弱い光を当てると明るい緑色の蛍光を発します。ところが、青色の光を非常に強く当てると、その吸収帯が無くなって、代わりに紫色領域に吸収が現れてきます。次に、紫色の光をそっと当てると、瞬時に、最初の状態に戻ります。異なる2つの波長の光で、緑色蛍光のオン(青色領域に吸収がある場合)と緑色蛍光のオフ(紫色領域に吸収がある場合)とを繰り返すことができます。緑色蛍光の消失、出現を、それぞれ“Dron(忍者用語で姿を晦ますこと)”、“pa(光活性化、photo- activationに由来)”になぞらえ、この蛋白質を「Dronpa(ドロンパ)」と命名しました。Dronpaをカバーガラスの上に一様に塗り広げ、アルゴンレーザー(488 nm)と半導体レーザー(405 nm)を搭載した通常の共焦点レーザー走査顕微鏡を使って、緑色蛍光の消去、書き込み、読み出しを行った実験を示します(図1)。これは、「書き換え可能な分子メモリーシステム」と呼ぶことができます。CD-RWやDVD-RWに相当するものと言えるでしょう。フォトクロミック分子といえば、ジアリールエテンなどの有機化合物などが光メモリーの新材料として注目されています。しかし、フォトクロミック蛍光を蛋白質で実現したのは、今回の成果が初めてです。遺伝子導入で発現可能、水環境で動作可能、生分解可能といったバイオマテリアルとしての特長を生かした応用が期待できます。
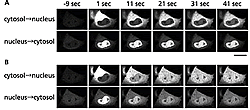
我々は、Dronpaを使った可逆的光ラベル技術を細胞生物学実験に応用しました。細胞内には、外界の刺激に応答して、細胞質と核とを行ったり来たりする分子がたくさんあります。なかでもMAP kinase (MAPK)と呼ばれる酵素は有名です。増殖因子などの刺激が来ると、細胞質から核へ移行し、さまざまな転写因子をリン酸化して、遺伝子発現を制御すると考えられています。細胞の増殖、分化の過程で中心的な働きをしており、さまざまな疾病に関わっていることが分かってきています。そこで、MAPKのあるアイソフォームであるERK1にDronpaを融合したERK1-Dronpaを培養細胞に発現させました。全体の蛍光を消去した後、細胞質にある ERK1-Dronpaを光ラベルし、それらが核へ移行する様を観察し、その後再び全体を消去し、今度は核にあるERK1-Dronpaを光ラベルし、それらが細胞質へ移行する様を観察しました。どちらの移行ともに効率が低いことが認められました(図2A)。続いて、同じ細胞に上皮増殖因子(EGF)をふりかけた上で、上記の細胞質→核、核→細胞質を見る実験を何回も繰り返しました。EGF添加後10~15分してから、ERK1-Dronpaの移行が両方向性に亢進するのが観察されました(図2B)。核におけるMAPKの情報制御が、この酵素の細胞質―核間のシャトリング(行き来)のスピードによって制御されていることを、初めて証明することができました。