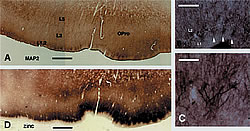
1層と2層の境界では、2層のニューロンの尖頭の樹状突起が明瞭なクラスターを形成している(微小管関連プロテイン(MAP2)の免疫組織化学)。
B: 亜鉛組織化学によって反応した隣接標本。亜鉛陽性終末のクラスターのサイズと位置が樹状突起のクラスターのそれと同様である。
CおよびD: 樹状突起クラスターの拡大写真。図B のうち3つは白い矢印で示されている。
スケールはAとDは1.0mm、Bは160µm、Cは80µm。
私たちのラボは、視覚認識その他の高次過程の構造的な土台である大脳皮質構築の研究を行っています。大脳皮質には細胞の集合としての核とは反対に層構造があるという基本的特徴は100年以上も前から知られていました。他の特徴としては、皮質は多くの識別可能な領域に分けられるというものがあります。さらに皮質にはある種の縦に伸びるコラム構造があるということが1940年代から認識されていましたが、それやその他の特徴が皮質の機能とどのように関連しているかは中心的な問題のままです。1990年代に特に普及していた見解によれば、皮質は基本的に『均質』で、反復的な回路の大きな配列で構成されており、それによって基本的な情報処理をするとされていました。ここに存在する単純性は魅力的で優雅でもありますが、実際にはいまだ真の標準的回路または普遍的皮質計算過程のどのような具体的な青写真も浮かび上がってはいないといえます。現実に領域または種特異的なニューロンタイプ、構成様式、遺伝子や遺伝子組み合わせの例は多数存在し、さらに現在の見解は共通して、柔軟性、およびその結果としての多様性の存在を推定しています。この大脳皮質の柔軟性・多様性は、大脳皮質の急速に変化し予測のつかない環境によりよく対応できる能力を考えるとより納得がいくかと思います。
皮質各領域のおおまかな連絡は、トレーサ注入を利用した実験によって多くの研究室で確定されています。注入は通常は細胞外で行われ、数百または数千のニューロンが一般的には直径0.5~3mm程度の場所にラベルされます。この技法により、どの領域が相互連絡しているかがわかり、また起点のニューロンと終点の層とを示すことも可能です。この結果、皮質連絡について、フィードフォワードとフィードバックの2種類の大分類が識別されました。便宜のため単純化して言うとこの2つは『ボトムアップ』と『トップダウン』という認知現象と同一視することも可能ですが、これらの連絡の詳細な機能、サブタイプ、さらに基本回路は、ほとんど知られないまま残されています。
私たちのラボは今のところ、シナプス前性要素、すなわち軸索及び軸索終末に集中した研究を行っています。とりわけ皮質皮質投射、視床皮質投射、最近では扁桃体皮質投射システムを調べています。これらの投射はどれも興奮性のもので神経伝達物質としてグルタミン酸を使用していますが、将来の研究ではさまざまな源からの入力がどのように収束し、シナプス後部のターゲットとの関連でどのように相互作用を行うかを対象とする必要があります。これらの問題の解剖学的研究には、シナプス前部と後部の両方を高い信頼度で可視化することが必要であるため、私たちは現在これを行うための方法を検討しています。
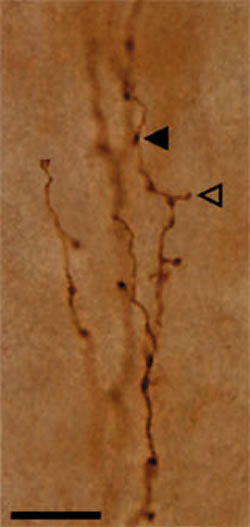
私たちのラボの主要な新成果は、多数の種の多くの皮質領域の浅層における小規模なハニカム状モジュラリティの発見です(一戸他2003年、一戸とロックランド2004年)。領域特異的なバリエーションがありますが、この構造は亜鉛を高濃度に含む皮質由来の終末がハニカム壁(wall)において抑制性のパルブアルブミン陽性終末と混じり合い、これと入れ子状にハニカム中空部(hollow)に高頻度の視床由来の終末が存在するという構造になっています。他に2層錐体細胞の尖頭樹状突起がハニカム壁に、深層錐体細胞の尖頭樹状突起がハニカム中空部に優位に存在しています。この構造は皮質1層と2層の境界に局在しているため、私たちはそれが皮質フィードバック、およびこの範囲に密に終末している扁桃体由来の入力と緊密な関係があると考えています。実際、現在進行中の研究において、フィードバック皮質投射の主要な源である2層と6層のニューロンは亜鉛陽性終末の主要な源であることが見出されています。
これらの発見が意味していることのひとつには、新皮質においても、大脳辺縁皮質と同様に2層が特殊で重要な役割を果たしている可能性があるということです。さらに、ハニカム壁内に高いレベルで亜鉛が存在するということは、以前からシナプスの可塑性と関連づけられてきている海馬のCA3セクターの亜鉛を多く含む苔状繊維終末を思い出させます。シナプスのレベルで、亜鉛はNMDAレセプターおよびその他のシナプス後部に存在する分子と結合し阻害していることが知られています。従って、亜鉛陽性のグルタミン酸作動性のシナプスは、シナプスのダイナミクスと可塑性の調節に新たな次元を追加している可能性があります。最後に、亜鉛ハニカムには領域による違いがあり、霊長類では感覚野の反対の意味での運動野および辺縁系皮質でより発達している、ということを強調しておきます。私たちはこのような領域差が各領域の構造的、機能的におけるどのような差異を反映しているのか、細胞レベル、回路レベルで調べていきたいと思っています。
私たちの亜鉛陽性終末に対する関心は、正常な皮質構造という視点からのものでした。しかし、シナプスでの亜鉛の放出は病的状態のてんかんやアルツハイマー病の病態生理においても大きな役割を果たしていると信じられています。
亜鉛の細胞間および細胞内のメッセンジャーとしての作用を、カルシウムによる作用と比較する研究者も存在します。この可能性の正否に関わらず、亜鉛が皮質機能において重要な役割を演じていることはすでに明白であり、亜鉛ハニカムは、シナプスの調節と回路の特性を探るための興味深い新しい方法を与えてくれるものです。